本指导原则的主要目的是规范碱性磷酸酶检测试剂(盒)的技术审评工作,帮助审评人员理解和掌握该类产品的原理、组成、性能、预期用途等内容,明确技术审评过程中应该关注和重点把握的内容,对产品安全性、有效性作出系统评价。
本指导原则是对碱性磷酸酶检测试剂(盒)的一般要求,审评人员应依据产品的具体特性确定其中的具体内容是否适用并对注册申报资料的内容进行补充要求。
本指导原则是对技术审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。应在遵循相关法规、国家标准、行业标准的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
一、适用范围
碱性磷酸酶检测试剂(盒)是指基于分光光度法原理对人血清、血浆或其他体液中的碱性磷酸酶活性进行体外定量分析的试剂。本指导原则适用于进行首次注册申报和相关许可事项变更的产品。
碱性磷酸酶活性的测定方法目前主要有连续监测法和比色法两类:
1. 连续监测法(磷酸对硝基苯酚底物法)
碱性磷酸酶催化水解磷酸对硝基苯酚(4-NPP),生成对硝基苯酚(4-NP),在特定波长处监测吸光度变化速率,可计算碱性磷酸酶活性。
2. 比色法(磷酸苯二钠底物法)
碱性磷酸酶催化水解磷酸苯二钠,生成游离酚,酚与4-氨基安替比林结合,经铁氰化钾氧化生成红色的醌衍生物,在特定波长处监测吸光度值,可计算碱性磷酸酶活性。
从方法学考虑,本文主要指以碱性磷酸酶水解底物引起特定产物的吸光度的改变对碱性磷酸酶活性进行定量检测的体外诊断试剂,不包括干化学、酶联免疫及金标类检测试剂。前列腺碱性磷酸酶试剂不属于本指导原则涵盖的范畴。
依据《体外诊断试剂注册管理办法》(试行)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号),肌酸激酶检测试剂属于酶类检测试剂,管理类别为Ⅱ类,分类代号为6840。
二、基本要求
(一)综述资料
综述资料主要包括产品预期用途、产品描述、方法学特征、生物安全性评价、研究结果总结以及同类产品上市情况介绍等内容,应符合《体外诊断试剂注册管理办法(试行)》(以下简称《办法》)和《体外诊断试剂注册申报资料形式与基本要求》的相关要求。相关描述应至少包含如下内容:
1.产品预期用途及辅助诊断的临床适应症背景情况:
(1)碱性磷酸酶的生物学特征、结构与功能,在体内正常和病理状态下的代谢途径和存在形式。
(2)与预期用途相关的临床适应症背景情况,如临床适应症的发生率、易感人群等,相关的临床或实验室诊断方法等。
2.产品描述:包括产品所采用的技术原理,主要原材料的来源及制备方法,主要生产工艺过程及关键控制点,质控品、校准品的制备方法及溯源情况。
3.有关生物安全性方面的说明:由于体外诊断试剂中的主要原材料可能是由各种动物、病原体、人源的组织和体液等生物材料经处理或添加某些物质制备而成,为保证产品在运输、使用过程中对使用者和环境的安全,研究者应提供对上述原材料所采用的灭活等试验方法的说明。
4.有关产品主要研究结果的总结和评价。
5.其他:包括同类产品在国内外批准上市的情况。相关产品所采用的技术方法及临床应用情况,申请注册产品与国内外同类产品的异同等。对于新诊断试剂产品,需提供被测物与预期适用的临床适应症之间关系的文献资料。
(二)产品说明书
说明书承载了产品预期用途、试验方法、检测结果解释以及注意事项等重要信息,是指导实验室工作人员正确操作、临床医生针对检验结果给出合理医学解释的重要依据,因此,产品说明书是体外诊断试剂注册申报最重要的文件之一。
结合《体外诊断试剂说明书编写指导原则》的要求,下面对碱性磷酸酶检测试剂说明书的重点内容进行详细说明。
1.【产品名称】
(1)试剂(盒)名称由三部分组成:被测物名称、用途、方法或原理。例如:碱性磷酸酶检测试剂盒(磷酸对硝基苯酚底物法)。
(2)英文名称应当正确、完整、直译,不宜只写缩写。
2.【包装规格】
包装规格应明确单、双或其他多试剂类型;如不同包装规格有与之特定对应的机型,则应同时明确适用机型。
如: R1:1×60ml,R2: 1×15ml 日立7170生化分析仪
3.【预期用途】应至少包括以下几部分内容:
3.1说明试剂盒用于体外定量检测血清、血浆和/或其他体液中碱性磷酸酶的活性;同时应明确与目的检测物相关的临床适应症背景情况。
3.2碱性磷酸酶异常情况常见于哪些疾病,其升高或降低可能有哪些医学解释。
如:碱性磷酸酶主要用于阻塞性黄疸、肝胆疾病、骨组织疾病等的检查。生理性增高:儿童在生理性的骨骼发育期,碱性磷酸酶活力可比正常人高1~2倍;病理性升高:(1)骨骼疾病如佝偻病、软骨病等;(2)肝胆疾病如肝外胆道阻塞、肝硬化、毛细胆管性肝炎等;(3)其他疾病如甲状旁腺机能亢进。病理性降低:见于重症慢性肾炎、儿童甲状腺机能不全、贫血等。
作为支持性资料,申请人应提供由教科书、临床专著、核心期刊文献或英文SCI文献等有关临床适应症背景的资料。
4.【检验原理】应结合产品主要成分简要说明检验的原理、方法,必要时可采取图示方法表示,检测原理的描述应结合产品主要组成成分、被测物和产物的关系进行描述:
如:本产品以磷酸对硝基苯酚(4-NPP)为底物,2-氨基-2-甲基-1-丙醇(AMP)为磷酸酰基受体物质,增进酶反应速率,在碱性磷酸酶(ALP)催化下,4-NPP分裂出磷酸基团,生成游离的对硝基苯酚(4-NP),后者在碱性溶液中转变成醌式结构,呈现较深的黄色。反应式如下:
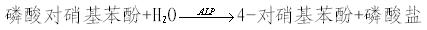

由于反应中4-NP的生成速率与ALP活性呈正比,因此在37℃、405nm波长下监测吸光度上升速率,可得出ALP的活性。
5.【主要组成成份】应明确以下内容:
试剂盒提供的试剂组分的名称、比例或浓度,各组分是否可以互换;如含有校准品或质控品,除明确组成成份及生物学来源外,还应明确其定值及溯源性,溯源性应写明溯源的最高级别,包括标准物质或参考物的发布单位及编号,质控品应明确靶值范围。
例如:
本试剂盒由R1、R2和校准品(选购)组成:
R1: AMP 1.0 mmol/L,硫酸锌 1.5 mmol/L,醋酸镁 2.5 mmol/L, N-羟乙基乙二胺三乙酸(HEDTA) 2.5mmol/L。
R2:磷酸-4-硝基苯酚 100 mmol/L,氯化镁10.5 mmol/L
校准品:含有碱性磷酸酶的人源血清基质,校准品具有批特异性,每批定值,定值见瓶签标示,量值可溯源至国际参考物质JCCLS CRM001b。
6.【储存条件及有效期】应明确未开封的试剂实际储存条件及有效期,开封后的待机稳定期或开瓶稳定期。干粉试剂应明确复溶稳定期。
注:保存条件不应有模糊表述,如“常温”、“室温”。
7.【适用仪器】应明确可适用的具体品牌、型号的生化分析仪器。
8.【样本要求】重点明确以下内容:样本类型、处理、保存期限及保存条件(短期、长期),运输条件等。如有血浆样本,应注明对抗凝剂的要求(如草酸盐、柠檬酸盐、EDTA钠盐对碱性磷酸酶活性造成干扰,应明确避免使用的提示)。冷藏/冷冻样本检测前是否须恢复室温,可冻融次数。特殊体液标本还应详细描述对采集条件、保存液、容器要求等可能影响检测结果的要求。
9.【检验方法】详细说明试验操作的各个步骤,包括:
9.1试剂配制方法、注意事项;
9.2试验条件:温度、时间、测定主/副波长、试剂用量、样本用量、测定方法、反应类型、反应方向、反应时间等以及试验过程中的注意事项;
9.3校准:校准品的使用方法、注意事项、校准曲线的绘制。
9.4质量控制:质控品的使用方法、对质控结果的必要解释以及推荐的质控周期等;建议在本部分注明以下字样:如果质控结果与预期不符,提示检测结果不可靠,不应出具检测报告。
9.5检验结果的计算:应明确检验结果的计算方法。超出线性范围的样本如进行稀释,应结合可报告范围研究结果明确稀释液类型和最大可稀释比例。
10.【参考值(范围)】应注明常用样本类型的正常参考值(范围),成人、儿童应按性别和年龄段,分别明确参考范围,并说明参考值确定方法。建议注明“由于地理、人种、性别和年龄等差异,建议各实验室建立自己的参考范围”。
11.【检验结果的解释】说明可能对检验结果产生影响的因素,在何种情况下需要进行确认试验。
12.【检验方法的局限性】说明该检验方法的局限性,如:存在的干扰因素,明确黄疸、溶血、脂浊及药物等内、外源性干扰物对测定的影响,同时列出干扰物的具体浓度。
13.【产品性能指标】至少应详述以下性能指标,性能指标应不低于标准有关技术指标的要求。
13.1空白吸光度及空白吸光度变化率;
13.2分析灵敏度;
13.3准确度;
13.4精密度(重复性和批间差);
13.5线性范围(线性相关系数和线性偏差)。
14.【注意事项】应至少包括以下内容:
14.1本试剂盒的检测结果仅供临床参考,对患者的临床管理应结合其症状/体征、病史、其他实验室检查及治疗反应等情况综合考虑。
14.2本试剂盒仅供体外诊断用,试剂中含有的化学成分接触人体后是否会产生不良的影响后果。
14.3采用不同方法学的试剂检测所得结果不应直接相互比较,以免造成错误的医学解释;建议实验室在发给临床医生的检测报告注明所用试剂特征。
14.3 有关人源组分的警告,如:试剂盒内的质控品、校准品或其他人源组分,虽已经通过了HBs-Ag、HIV1/2-Ab、HCV-Ab等项目的检测,但截至目前,没有任何一项检测可以确保绝对安全,故仍应将这些组分作为潜在传染源对待。
14.4样本:(1)采集时间要求、与用药的先后顺序或用药后时间间隔等;(2)对所有样本和反应废弃物都应视为传染源对待。
14.5其他有关碱性磷酸酶测定的注意事项。
15.【参考文献】应当注明在编制说明书时所引用的参考文献。
16.【生产企业】应当注明企业名称、地址(如注册地址与生产地址不一致,应当分别列出)、邮政编码、电话和传真号码、网址(如有)。
17.【医疗器械生产企业许可证编号】、【医疗器械注册证书编号】、【产品标准编号】、【说明书批准及修改时间】,未核准的内容可空缺。
(三)拟定产品标准及编制说明
拟定产品标准应符合《体外诊断试剂注册管理办法》和《体外诊断试剂注册申报资料基本要求》的相关规定。如已有相应的国家/行业标准发布,则企业标准的要求不得低于其相关要求。
下面就标准中涉及的产品适用的相关标准和主要性能指标等相关内容作简要叙述。
1. 产品适用的相关标准:
(1)GB/T2829-2002周期检验计数抽样程序及表(适用于对过程稳定性的检验)
(2)GB/T 21415—2008体外诊断医疗器械 生物样品中量的测量 校准品和控制物质赋值的计量学溯源性
(3)GB/T 191-2008 包装储运图示标志
(4)YY/T 0316-2008 医疗器械 风险管理对医疗器械的应用
(5)YY/T 0638—2008体外诊断医疗器械 生物样品中量的测量 校准品和控制物质物中酶催化浓度赋值的计量学溯源性
(6)YY/T0466.1-2009医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求
(7)GB/T 26124-2011 临床化学体外诊断试剂(盒)
(8)WS/T351— 2011 碱性磷酸酶(ALP)催化活性浓度测定参考方法
(9)GB/T 2828.1-2012 技术抽样检程序 第1部分:按接收质量限(ALQ)检索的逐批检验抽样计划
(10)WS/T404.1-2012临床常用生化检验项目参考区间血清丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、碱性磷酸酶和γ-谷氨酰基转移酶
2.主要性能指标:
(1)外观:
应与申请人声称试剂外观一致。这里可以包括试剂盒包装外观、试剂内包装外观、试剂的外观。
(2)装量(冻干品不适用):
试剂装量应不少于标示装量。
(3)空白吸光度:
用蒸馏水、去离子水或其他指定溶液作为空白加入工作试剂作为样品测试时,试剂空白吸光度应不大于企业规定的要求。
(4)空白吸光度变化率:
用蒸馏水、去离子水或其他指定溶液作为空白加入工作试剂作为样品测试时,试剂空白吸光度变化率△A/min(37℃,405nm,1cm)≤0.005。
(5)分析灵敏度
用已知浓度或活性的样品进行测试,记录在试剂(盒)规定参数下产生的吸光度改变。换算为n单位吸光度差值(ΔA)或吸光度变化(ΔA/min)。应符合生产企业给定范围。
(6)线性范围
用达到线性范围上限活性的样品和达到线性范围下限活性的样品,混合成至少5个稀释浓度(xi)。分别测试试剂盒,每个稀释浓度测试3次,分别求出测定结果的均值(yi)。以稀释浓度(xi)为自变量,以测定结果均值(yi)为因变量求出线性回归方程。按公式(1)计算线性回归的相关系数(r)。
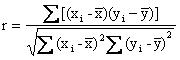 …………………………………(1)
…………………………………(1)
稀释浓度(xi)代入求出线性回归方程,计算yi的估计值及yi与估计值的相对偏差或绝对偏差。
线性范围应至少达到但不限于25~750U/L(下限不得高于25U/L,上限不得低于750U/L)。
①相关系数(r)
线性相关系数r应不小于0.990。
(线性范围下限应不低于产品的最低检测限,不高于参考范围下限)
②25-100U/L范围内,线性绝对偏差应不超过±10U/L;101-750范围内,线性相对偏差应不超过±10%。
(7)测量精密度
①批内重复性
在重复性条件下,分别用试剂(盒)测试(50±10)U/L和(500±50)U/L的样本或质控样品,重复测试至少10次(n≥10),分别计算测量值的平均值(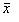 )和标准差(s)。计算变异系数(CV),应不大于5%。
)和标准差(s)。计算变异系数(CV),应不大于5%。
②批内瓶间差(干粉或冻干试剂)
用(120±12) U/L的样本或质控样品测试同一批号的10个待检试剂(盒),并计算10个测量值的平均值(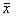 1)和标准差(s1)。
1)和标准差(s1)。
用(120±12) U/L的样本或质控样品对该批号的1个待检试剂(盒)重复测试10次,计算结果的均值(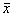 2)和标准差(s2)。按公式(2)、
2)和标准差(s2)。按公式(2)、
(3)计算瓶间差的变异系数(CV)。
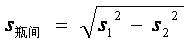 ……………………………………(2)
……………………………………(2)
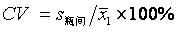 ……………………………………(3)
……………………………………(3)
当s1<s2时,令CV=0
每个浓度下试剂(盒)批内瓶间差均应不大于5%。
③批间差
用(120±12) U/L的样本或质控样品分别测试3个不同批号的试剂(盒),每个批号测试3次,分别计算每批3次测定的均值 (i=1,2,3),按公式(4)、(5)计算相对极差(R)。
(i=1,2,3),按公式(4)、(5)计算相对极差(R)。
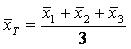 ………………………………………(4)
………………………………………(4)
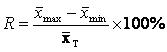 ……………………………………(5)
……………………………………(5)
式中:
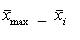 中的最大值;
中的最大值;
 中的最小值。
中的最小值。
试剂(盒)批间差相对极差应不大于10%。
(8)准确度
①型式检验
相对偏差:
用试剂盒测定用评价常规方法的参考物质或有证参考物质或由参考方法定值的高、中、低三个浓度的人源样品,测定值与标示值偏差应≤10%。
比对试验:
用待测试剂盒与申请人选定分析系统(已在国内上市)分别检测不少于40个在检测范围内的人源样品,用线性回归方法计算两组结果的相关系数r2≥0.95,相对偏差≤10%。
②出厂检验
推荐使用型式试验的方法进行检测,申请人也可使用经内部定值的质控品进行检测,测得值与标示值偏差不得大于10%。
测定样本应至少包含两个浓度点,一般应按医学决定水平取碱性磷酸酶(ALP)正常值和异常值浓度点。
备注:选用经定值的质控品进行出厂检验,申请人应能提供型式试验方法与出厂检验方法等同的研究资料。
(9)稳定性
检测申请人声称已到期试剂,产品性能应符合空白吸光度、吸光度变化率、分析灵敏度、线性、测量精密度、准确度要求。
冻干品应同时进行复溶稳定性试验,复溶后放置到有效期末,产品性能应符合空白吸光度、吸光度变化率、分析灵敏度、线性、测量精密度、准确度要求。
(10)校准品和质控品的性能指标(如产品中包含)
应至少包含外观、装量(干粉试剂可不做)、准确性、均一性、稳定性。冻干型校准品和质控品还应检测批内瓶间差和复溶稳定性。
(11)型式检验和出厂检验要求
型式检验应包含标准中规定的所有性能指标;出厂检验应包含标准中除稳定性、批间差以外的所有性能指标。
(四)注册检测
首次申请注册的二类产品应该在国家食品药品监督管理部门认可的、具有相应承检范围的医疗器械检测机构进行至少三个生产批次样品的注册检测。
(五)主要原材料研究资料(如需提供)
应提供主要原材料、校准品(如产品包含)、质控品(如产品包含)的选择、制备、质量标准及验证有关的研究资料。
(六)主要生产工艺和反应体系的研究资料(如需提供)
应包含产品的工艺流程图和关键控制点、确定反应温度、时间、缓冲体系比较等条件的研究资料、确定样本和试剂盒组分加样量的研究资料。
ALP缓冲液通常分为三类:1.惰性型:如碳酸盐缓冲液和巴比妥缓冲液;2.抑制型:如甘氨酸缓冲液;3.激活型:如AMP、Tris和DEA缓冲液。激活型缓冲液,缓冲物质作为酶的一种底物(磷酸酰基的受体),参与磷酸酰基的移换反应,因此能促进酶促反应速率。使用最适浓度和激活型缓冲液时,所测的ALP活性要比使用惰性型缓冲液(如碳酸盐缓冲液)时高2~6倍。DEA的激活作用比AMP的激活作用更强,因此,用不同缓冲液测定ALP活性时,其参考值不同。
ALP活性与血清在反应液中所占的体积百分数有关。当血清体积分数从1/26降低到1/51时,测出的酶活性随之增高;但低于1/51时,酶活性没有进一步增加。
(七)分析性能评估资料
应至少包括具体的研究方法、试验数据、统计方法、研究结论等。性能评估时应将试剂和所选用的校准品、质控品作为一个整体进行评价,评估整个系统的性能是否符合要求。
性能评估应至少包括准确度、精密度、线性范围、最低检测限、分析特异性(抗干扰能力)、其他影响检测的因素等。
1. 准确度
对测量准确度的评价依次包括:与国家标准品(和/或国际标准品)的偏差分析、方法学比对等方法,申请人可根据实际情况选择合理方法进行研究。
1.1与国家(国际)标准品的比对研究
如果研究项目有相应国家标准物质或国际参考物质,则使用国家标准物质或国际参考物质进行验证,计算检测结果与靶值的相对偏差。(注:碱性磷酸酶项目目前有国家标准物质和国际参考物质)
1.2方法学比对
采用参考方法或国内/国际普遍认为质量较好的已上市同类试剂作为参比方法,与拟申报试剂同时检测一批病人样品(至少40例样本),从测定结果间的差异了解拟申报试剂与参比方法间的偏倚。如偏倚很小或在允许的误差范围内,说明两检测系统对病人标本测定结果基本相符,对同一份临床样本的医学解释,拟申报试剂与参比方法相比不会产生差异结果。
在实施方法学比对前,应分别对拟申报试剂和参比试剂进行初步评估,只有在确认两者都分别符合各自相关的质量标准后方可进行比对试验。方法学比对时应注意质量控制、样本类型、浓度分布范围并对结果进行合理的统计学分析。其中,浓度分布应覆盖产品的可报告范围。
2. 精密度
测量精密度的评估应至少包括两个浓度水平的样本进行,两个浓度都应在试剂盒的测量范围内且有一定的临床意义,通常选用该检测指标的正常参考值附近和异常高值样本。
测量精密度的评价方法并无统一的标准可依,可根据不同的试剂特征或申请人的研究习惯进行,前提是必须保证研究的科学合理性。
3. 线性范围
建立试剂线性范围所用的样本基质应尽可能与临床实际检测的样本相似,理想的样本为分析物浓度接近预期测定上限的混合人血清,且应充分考虑多倍稀释对样本基质的影响。
超出线性范围的样本如需稀释后测定,应作相关研究,明确稀释液类型及最大可稀释倍数,研究过程应注意基质效应影响,必要时应提供基质效应研究有关的资料。
4. 最低检测限
最低检测限的确定常使用同批号试剂对零浓度校准品(或样品稀释液)进行至少20次重复检测,平均值加2倍SD(≥95%置信区间)即试剂的最低检测限。
5. 分析特异性
应明确已知干扰因素对测定结果的影响:可采用回收实验对不同浓度的溶血、黄疸、脂血对检测结果的影响进行评价,干扰物浓度的分布应覆盖人体生理及病理状态下可能出现的物质浓度。待评价的碱性磷酸酶样本浓度至少应为高、中、低三个水平,选取线性范围内有临床代表性意义的浓度。
药物干扰的研究可根据需要由申请人选择是否进行或选择何种药物及其浓度进行。
7. 校准品溯源及质控品赋值
校准品、质控品应提供详细的量值溯源资料,包括定值试验资料和溯源SOP文件等。应参照GB/T 21415—2008《体外诊断医疗器械 生物样品中量的测量 校准品和控制物质赋值的计量学溯源性》的要求,提供企业(工作)校准品及试剂盒配套校准品定值及不确定度计算记录,提供质控品赋值及其靶值范围确定的记录。
8. 其他需注意问题
原则上,不同适用机型、不同包装规格,应分别提交分析性能评估报告;适用机型必须明确具体型号,不能写系列,且应分别进行分析性能评估;不同包装规格如选择典型包装规格进行分析性能评估,申请人应提交典型包装规格可代表其他包装规格的依据或情况说明。不同样本类型应分别进行分析性能评估。
分析性能评估报告应明确研究所用临床样本来源,明确所用仪器、校准品、质控品等的产品名称、生产企业名称、注册证号或注册证等信息。如分析性能评估研究在医疗或临床检验机构进行,应提供合作协议,明确仪器设备型号、校准品质控品来源、样本来源及类型、待评价产品名称等。
(八)参考值(范围)确定资料
应明确研究采用的样本来源、详细的试验资料、统计方法等,参考值范围可参考教科书或文献资料,但应当进行验证。不同性别、不同年龄段、不同样本类型验证样本例数应分别达到120例以上。研究结论应与产品说明书【参考范围】的相应描述保持一致。
(九)稳定性研究资料
试剂的稳定性通常包括实时稳定性、加速稳定性、运输稳定性、开瓶(待机)稳定性、复溶稳定性等,申请人应至少提供实时稳定性和开瓶稳定性研究资料,干粉试剂同时应提供复溶稳定性研究资料(各3个生产批次),加速稳定性和运输稳定性资料可在技术审评过程需要时提供。申请人提供的稳定性研究资料应包括研究目的、材料和方法、研究结论等,研究应涵盖产品的所有主要性能指标,申请人应至少能提供稳定性末期的全性能检测报告。试剂的稳定性研究应注意选取代表性包装规格进行研究(例如:校准品稳定性应选取最易受影响的最小装量),实时稳定性研究的时间间隔应不大于3个月。
(十)临床试验研究
临床研究资料应符合《体外诊断试剂临床研究技术指导原则》要求,同时研究资料的形式应符合《体外诊断试剂注册申报资料形式要求》临床研究资料有关的规定。下面仅对临床实验中的基本问题进行阐述。
1. 研究方法
选择境内已批准上市的性能不低于拟申报产品的同类产品作为参比试剂,采用拟申报产品(以下称待评试剂)与之进行对比试验研究,证明本品与已上市产品等效。
2. 临床研究单位的选择
应选择至少两家省级卫生医疗机构,临床研究单位实验操作人员应有足够的时间熟悉检测系统的各环节(试剂、质控及操作程序等),熟悉评价方案。在整个实验中,待评试剂和参比试剂都应处于有效的质量控制下,最大限度保证试验数据的准确性及可重复性。
3. 临床试验方案
临床试验实施前,研究人员应从流行病学、统计学、临床医学、检验医学等多方面考虑,设计科学合理的临床研究方案。各临床研究机构的方案设置应保持一致,且保证在整个临床试验过程中遵循预定的方案实施,不可随意改动。整个试验过程应在临床研究机构的实验室内并由本实验室的技术人员操作完成,申报单位的技术人员除进行必要的技术指导外,不得随意干涉实验进程,尤其是数据收集过程。
试验方案中应确定严格的病例纳入/排除标准,任何已经入选的病例再被排除出临床研究都应记录在案并明确说明原因。在试验操作过程中和判定试验结果时应采用盲法以保证试验结果的客观性。各研究单位选用的参比试剂及所用机型应保持一致,以便进行合理的统计学分析。另外,待评试剂的样本类型应与产品说明书一致,且不应超越参比试剂对样本类型的检测要求,如果选择了参比试剂适用样本类型以外的样本,则应采用临床金标准对额外的样本类型进行验证。
4. 研究对象选择
临床试验应选择具有特定症状/体征人群作为研究对象。企业在建立病例纳入标准时,应考虑到不同人群的差异,尽量覆盖各类适用人群。在进行结果统计分析时,建议对各类人群分别进行数据统计分析。总体样本数不少于200例,异常值样本数不少于80例。
血清/血浆应明确抗凝剂的要求、存贮条件、可否冻融等要求及避免使用的样本。实验中,尽可能使用新鲜样本,避免贮存。如无法避免使用贮存样品时,注明贮存条件及时间,在数据分析时应考虑其影响。
样本中待测物浓度应覆盖待评试剂线性范围,且尽可能均匀分布。
5. 统计学分析
对临床试验结果的统计应选择合适的统计方法,如相关分析、线性回归、绝对偏倚/偏差及相对偏倚/偏差分析等。对于对比实验的等效性研究,最常用是对待评试剂和参比试剂两组检测结果的相关及线性回归分析,应重点观察相关系数(r值)或判定系数(R2)、回归拟合方程(斜率和y轴截距)等指标。结合临床试验数据的正/偏态分布情况,建议统计学负责人选择合理的统计学方法进行分析,统计分析应可以证明两种方法的检测结果无明显统计学差异。在临床研究方案中应明确统计检验假设,即评价待评试剂与参比试剂是否等效的标准。
6. 临床试验总结报告撰写
根据《体外诊断试剂临床研究技术指导原则》的要求,临床试验报告应该对试验的整体设计及各个关键点给予清晰、完整的阐述,应该对整个临床试验实施过程、结果分析、结论等进行条理分明的描述,并应包括必要的基础数据和统计分析方法。建议在临床总结报告中对以下内容进行详述。
(1)临床试验总体设计及方案描述
①临床试验的整体管理情况、临床研究单位选择、临床主要研究人员简介等基本情况介绍。
②纳入/排除标准、不同人群的预期选择例数及标准。
③样本类型,样本的收集、处理及保存等。
④统计学方法、统计软件、评价统计结果的标准。
(2)具体的临床试验情况
①待评试剂和参比试剂的名称、批号、有效期及所用机型等信息;
②对各研究单位的病例数、人群分布情况进行总合,建议以列表或图示方式给出具体例数及百分比。
③质量控制,试验人员培训、仪器日常维护、仪器校准、质控品运行情况,对检测精密度、质控品回收(或测量值)、抽查结果评估。
④具体试验过程,样本检测、数据收集、样本长期保存等。
(3)统计学分析
①数据预处理、对异常值或离群值的处理、研究过程中是否涉及对方案的修改。
②定量值相关性和一致性分析
用回归分析验证两种试剂结果的相关性,以y=a+bx和R2的形式给出回归分析的拟合方程,其中:y是待评试剂结果,x是参比试剂结果,b是方程斜率,a是y轴截距,R2是判定系数(通常要求R2≥0.95),同时应给出b的95%(或99%)置信区间。
建议给出待评试剂与参比试剂之间的差值(绝对偏倚/偏差)及比值(相对偏倚/偏差)散点图并作出95%置信区间分析。医学决定水平附近相对偏倚/偏差应不大于10%。
(4)讨论和结论
对总体结果进行总结性描述并简要分析试验结果,对本次临床研究有无特别说明,最后得出临床试验结论。
三、审查关注点
(一)关注产品预期用途有关的描述是否与临床研究结论一致。临床研究用参比试剂和第三方确认试剂的预期用途应与申请产品预期用途一致。申报样本类型应在临床研究中进行验证。
(二)审查产品标准时应注意产品应符合GB/T 26124-2011《临床化学体外诊断试剂(盒)》有关规定,准确度的出厂检验如使用质控品,应经过申请人内部定值并证明与型式试验所采用的方法等效。
(三)说明书中预期用途、储存条件及有效期、检验方法、参考范围、产品性能指标、抗干扰能力等描述应分别与临床研究资料、稳定性研究资料、主要生产工艺和反应体系研究资料、参考范围研究资料、分析性能评估资料的研究结论相一致。
(四)不同性别和年龄段,碱性磷酸酶参考范围差异较大,申请人应分别进行研究。
(五)干粉试剂应提供复溶稳定性研究资料并在说明书【储存条件及有效期】中说明。
四、名词解释
1. 准确度(accuracy):一个测量值与可接受的参考值间的一致程度。
2. 最低检测限(Lower detection limit):样品中以一定概率可被声明与零有差异的被测量的最低值。本指导原则中的最低检测限为区别于零的不低于95%可信区间的最低浓度。
3. 分析特异性(analytical Specificity):测量程序只测量被测量物的能力。用于描述检测程序在样本中有其他物质存在时只测量被测量物的能力。通常以一个被评估的潜在干扰物清单来描述,并给出在特定医学相关浓度值水平的分析干扰程度。(潜在干扰物包括干扰物和交叉反应物)
4. 线性(linearity):在给定测量范围内,给出的测量结果与样品中实际存在的被测量物的值成比例的能力。线性是描述一个测量系统的测量示值或测量结果相关于样本的赋值符合直线的属性。
5. 精密度(precision):在规定条件下,相互独立的测试结果之间的一致程度。精密度的程度是用统计学方法得到的测量不精密度的数字形式表示,如标准差(SD)和变异系数(CV)。
五、参考文献:
1.《体外诊断试剂注册管理办法(试行)》(国食药监械〔2007〕229号)
2.《体外诊断试剂临床研究技术指导原则》(国食药监械〔2007〕240号)
3.《体外诊断试剂说明书编写指导原则》(国食药监械〔2007〕240号)
4.《关于含有牛、羊源性材料医疗器械注册有关事宜的公告》(国食药监械〔2006〕407号
5.《全国临床检验操作规范》(第三版),中华人民共和国卫生部医政司
6.《临床化学常用项目自动分析法》(第三版),辽宁科技出版社
碱性磷酸酶检测试剂盒
产品注册技术审查指导原则编写说明
一、编写原则
(一)本指导原则编写的目的是用于指导和规范碱性磷酸酶检测试剂盒产品注册申报过程中审查人员对注册材料的技术审评。
(二)本指导原则旨在让初次接触该类产品的注册审查人员对产品诊断方法或原理、主要组分、主要性能指示、临床用途等各个方面进行基本了解,同时让技术审查人员在产品注册技术审评时把握基本的要求尺度,以确保产品的安全、有效。
(三)本指导原则中的碱性磷酸酶检测试剂(盒)是指基于分光光度法原理对人血清、血浆或其他体液中的碱性磷酸酶活性进行体外定量分析的试剂。
(四)本指导原则中的术语、定义采用GB/T 26124-2011《临床化学体外诊断试剂(盒)》标准的术语和定义。
二、编写依据
(一)《医疗器械监督管理条例》
(二)《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)
(三)《医疗器械临床试验规定》(国家食品药品监督管理局令第5号)
(四)《医疗器械说明书、标签和包装标识管理规定》(国家食品药品监督管理局令第10号)
(五)《医疗器械标准管理办法》(国家药品监督管理局令第31号)
(六)《体外诊断试剂注册管理办法(试行)》(国食药监械〔2007〕229号)
(七)《体外诊断试剂临床研究技术指导原则》(国食药监械〔2007〕240号)
(八)《体外诊断试剂说明书编写指导原则》(国食药监械〔2007〕240号)
(九)国家食品药品监督管理部门发布的其他规范性文件
三、重点内容说明
(一)指导原则主要根据体外诊断试剂产品注册申报资料的要求,借鉴国家食品药品监督管理部门已发布的相关产品注册技术审查指导原则的体例进行编写,以便于注册技术审评人员理解。
(二)在产品综述资料中,全面介绍了该类体外诊断试剂产品的预期用途、产品描述、方法学特征、生物安全性评价、研究结果总结以及同类产品上市情况介绍等内容。
(三)本指导原则不涉及产品作用机理的内容,主要描述相应的诊断方法和原理。
(四)产品应适用的相关标准中给出了现行有效的国家标准、行业标准(包括产品标准、基础标准),以及相应的国际标准。
(五)产品的主要性能指标中给出了产品需要考虑的各个方面,主要提出共性要求,具体量化指标需要参照相关的国家标准、行业标准和生产商技术能力予以确定。
四、编写单位
本指导原则主要由浙江省食品药品监督管理局医疗器械注册行政审批人员、浙江省药品认证中心注册技术审评人员、国家食品药品监督管理局杭州医疗器械检测中心检验人员、浙江省药品不良反应监测中心等有关人员组织编写。起草过程中广泛征求了国家食品药品监督管理总局医疗器械技术审评中心、相关省(市)局、有关医疗器械生产企业和临床使用单位的意见,以充分利用各方面的信息和资源,综合考虑指导原则中各个方面的内容,尽量保证指导原则可操作性和指导性。