吻(缝)合器产品注册技术审查
指导原则
本指导原则旨在指导和规范吻(缝)合器(以下简称吻合器)产品的技术审评工作,帮助审评人员理解和掌握该类产品原理、机理、结构、性能、预期用途内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性做出系统评价。
本指导原则所确定的核心内容是在目前对吻合器的科技认识水平和现有产品技术基础上形成的,因此,审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。
本指导原则不作为法规强制执行,不包括行政审批要求。但是,审评人员需密切关注相关法规的变化,以确认申报产品是否符合法规要求。
一、适用范围
本指导原则的适用范围为Ⅱ类吻合器。根据使用目的不同,本指导原则适用的吻合器可分别归类为6808腹部外科手术器械(例如:一次性使用直线型吻合器及组件、一次性使用弧线型吻合器及组件、一次性使用直线型切割吻合器及组件)和6809泌尿肛肠外科手术器械(例如:一次性使用管型吻合器及组件、一次性肛肠吻合器及组件)。
目前临床使用的具备“机械吻合”性能的器械种类繁多,本指导原则只收纳了产品设计(材料、结构)、生产工艺、技术性能和预期用途已相对成熟的“管型吻合器(含肛肠吻合器)、直线型吻合器、直线型切割吻合器和弧线型吻合器”产品。其它具备吻合功能的产品在设计、功能与预期用途方面与上述产品差异较大,有些产品甚至处于临床早期应用阶段,如皮肤缝合器、腔镜下使用吻合器未收录在本指导原则内。
二、技术审查要点
吻合器产品的命名应采用《医疗器械分类目录》或发布的国家标准、行业标准上的通用名称,或以产品结构性能和预期用途为依据命名。一般情况下,按照是否重复使用将吻合器分为重复使用和一次性使用两类,两类吻合器的结构和功能基本相同。重复使用吻合器又包括完全重复使用和仅仅吻合器器身重复使用两种。前者目前已退出市场,后者将吻合器控制击发部分(即器身)设计为可重复使用,用不锈钢等材料制成,可高温高压消毒,同时配有一定数量的一次性使用组件。这种组合使一台手术中一把吻合器使用多个吻合组件成为现实,大大降低了手术成本。
通常情况下,吻合器按照吻合后钉的排列形状和是否带有切割功能来命名。可重复使用的产品通用名称为“管型吻合器”、“直线型吻合器”、“直线型切割吻合器”和“弧线型吻合器”等。而预期一次性使用产品应带有“一次性使用”等字样。如“一次性使用管型吻合器” 、“一次性使用直线型吻合器”、“一次性使用直线型切割吻合器”、 “一次性使用弧线型吻合器”等。其中管型吻合器又按照用途不同分为管型吻合器(消化道)和肛肠吻合器(或称为痔吻合器)。
此外也允许企业在通用名称中冠以表示自身型号或企业特征的描述性词语等,如“KYWC系列一次性使用直线型吻合器”。
常见的产品名称举例:
一次性使用吻合器:
一次性使用管型吻合器及组件
一次性使用直线型吻合器及组件
一次性使用弧线型吻合器及组件
一次性使用直线型切割吻合器及组件
一次性肛肠吻合器及组件
重复使用的吻合器:
管型吻合器或管型吻合器及组件
直线型吻合器或直线型吻合器及组件
肛肠吻合器及组件
1.产品的结构和组成
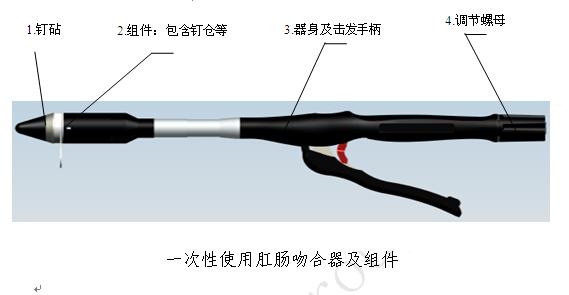
通常情况下每一副完整的吻合器最基础的组成是钉砧、器身和组件。钉砧又名抵钉座。组件是对吻合器中可更换部分的总称,通常包括钉仓、推钉片和吻合钉。具备切割功能的组件通常称为吻切组件。不具备切割功能的吻合器组件习惯称为吻合组件。在本指导原则中统一称为“组件”。
在此基础上为了实现特定的功能或者增加器械的安全有效性,制造商会增加一些其他组成。如用来固定被吻合组织的定位针,用来防止二次击发的保险机关以及调节螺母等等。以下将分别介绍。
2.典型吻合器产品结构示意图
(1)一次性使用管型(消化道)吻合器
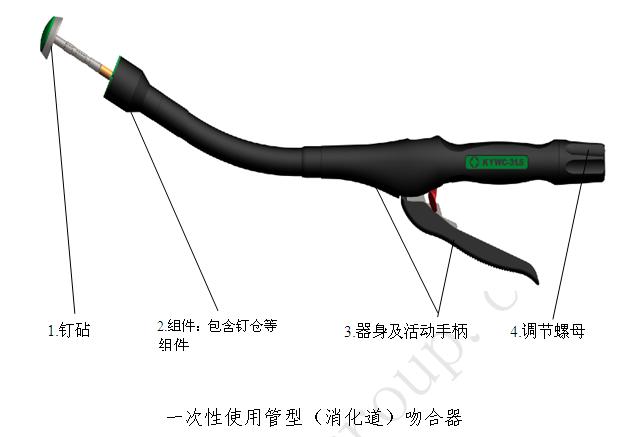
(2)一次性使用直线型吻合器及组件
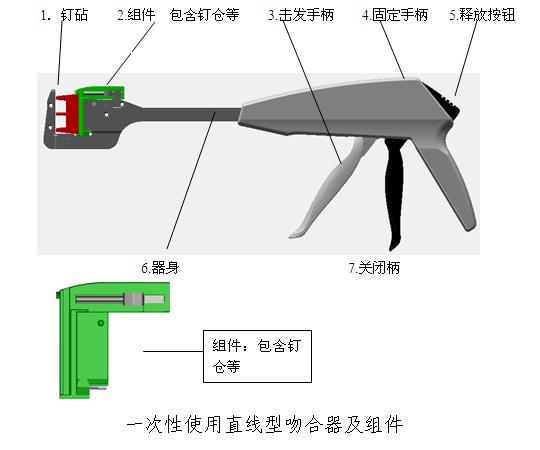
(3)一次性使用直线型切割吻合器及组件
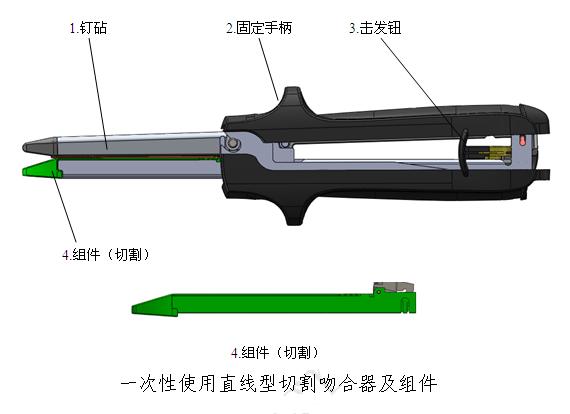
(4)一次性使用弧线型切割吻合器和组件
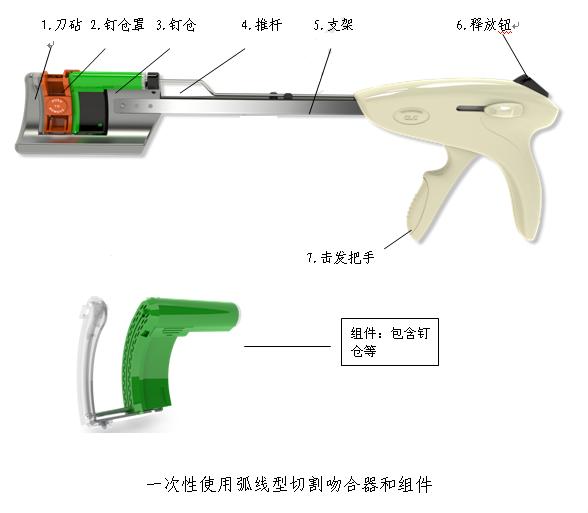
(5)一次性使用肛肠吻合器及组件
吻合器工作原理与订书机相似,故其总称为Stapler。 吻合器通过机械传动装置将预先放置在组件中,呈两排或数排互相平行错位排列的吻合钉击入已经对合好、需要吻合在一起的组织内,吻合钉在穿过两层组织后受到前方钉砧的阻挡,向内弯曲,形成“B”形互相错位排列,将两层组织永久性钉合在一起。由于小血管可以从“B”形缝钉的空隙中通过,故不影响缝合部位及其远端的血液供应,这种钉合可以实现稳定的,张弛合理的,益于被吻合组织愈合的效果。
吻合钉多数用金属钛或钽制成,具有较好的生物相容性。由于吻合钉排列整齐,间距相等,缝合松紧度由标尺控制,避免了手工缝合过疏过密和结扎过紧过松等缺陷,既保证了组织良好的愈合,同时也大大缩短了手术时间。
各种吻合器为达到“B”型缝钉的缝合,设计的主要部件有钉钻、组件、击发手柄,定位针,旋钮及标记尺等。为了切除吻合后多余组织,满足临床对吻合口及吻合效果的要求,还装备了各种刀具,如环形刀,推刀等。这些部件按一定的操作规程使用,保证组织缝合和吻合口的迅速、准确地完成。具体部件将在各类吻合器中介绍。
1.管型吻合器
管型消化道吻合器(简称为管型吻合器):此类型的吻合器是为管腔组织吻合而设计。按钉砧与器械体是否可分离分为分体式和连体式两类。按照是否可以调节吻合厚度分为可调节和不可调节两种型号。手术操作时,分别将待吻合的管腔组织两端套入并收紧荷包固定于钉砧和器械体上。再将钉砧与器械体对合连接,可调节型调节吻合器末端调节螺母,将吻合器钉砧和器械体之间收紧至预定位置,不可调节型由人工将吻合器钉砧和器械体靠近,然后进行击发即完成吻合,同时切除管腔内多余的组织,吻合完成后退出器械。
管型吻合器主要用于消化道重建手术中的端端、端侧和侧侧吻合。根据临床医生操作习惯一般将管身设计为直型和弯型两种类型。其中以弯型最常用,并按吻合器钉砧直径不同划分为若干规格,不同直径的管腔组织可选择不同的规格。
肛肠吻合器:是管型吻合器的一种,此类吻合器专为肛肠手术设计,原理上与管型吻合器基本相同,在器身和钉砧上存在差异。
使用该类吻合器进行的手术又称为PPH,即:选择性切除直肠齿状线上粘膜和粘膜下组织,恢复直肠下段正常解剖结构。
2.直线型吻合器
这种吻合器根据闭合间隙是否可调分为固定间隙和可调间隙两种型式。这种吻合器可将组织进行直线型缝合。将组织放在组件和钉砧之间,安置好定位针,根据组织厚度标尺设定好适合的厚度,扳动击发手柄,缝钉驱动器即将两排平行错位的缝钉植入组织并弯曲成“B”形,和订书机原理一样,牢固地将两层组织钉合封闭。这种吻合器无切割功能,在松开吻合器前,须沿缝合器边缘,切除多余组织。
这种吻合器的组件可以更换,并设计有防止二次击发和误击发装置。吻合后钉的排列形状通常呈直线形,适用于消化道重建和脏器切除手术中的残端或切口的关闭。因需要闭合组织的宽度和厚度不同,设计了多种规格长度的组件供临床选用,同一台手术,一把直线型吻合器可更换多个长度的组件。为配合临床合理机动使用,组件可做单独无菌包装。
3.直线型切割吻合器
直线型切割吻合器根据切割刀的装配位置分为器身带刀和组件带刀两种型式。产品设计了可以同时在组织的两侧各击入数排(常见的为两排)直线、平行错位排列的缝钉,用以钉合。使用时,将手柄压下两层组织进行固定以后,推动击发钮,向前方推进,推进过程中推刀在两侧已缝合好的组织之间进行切割离断。平行的吻合钉相互错位排列,可以很好地防止出血和渗漏。目前临床广泛应用于胃、空肠侧侧吻合,肠—肠侧侧吻合,胃腔制作,肺部分切除等手术,是一种同时能完成吻合与闭合二大功能的器械。同一台手术一把直线型切割吻合器可更换多个长度的组件。为配合临床合理机动使用,组件可做单独无菌包装。
4.弧线型切割吻合器
弧线型切割吻合器是在直线型吻合器和管型吻合器基础上设计开发出来的,弥补了手术视野暴露困难时,直线型切割吻合器无法顺利操作的缺陷。弧线型切割吻合器组件可以置换。同一台手术一把弧线型切割吻合器可更换多个组件。为配合临床合理机动使用,组件可做单独无菌包装。
弧线型切割吻合器临床用于消化道重建和脏器切除手术中的残端或切口的关闭,该器械由于特别的弧形头设计,特别适用于盆腔底部手术暴露困难的部位。
因该产品为非治疗类医疗器械,故本指导原则不包含产品作用机理的内容。
表1 相关产品标准
|
GB/T 191-2008 |
《包装储运图示标志》 |
|
GB/T 9969-2008 |
工业产品使用说明书 总则 |
|
GB/T 230.1-2009 |
《金属洛氏硬度试验方法 第1部分:试验方法》 |
|
GB 1220-2007 |
《不锈钢棒》 |
|
GB/T 4340.1-2009 |
《金属维氏硬度试验方法 第1部分:试验方法》 |
|
GB/T 2828.1-2003 |
《计数抽样检验程序 第1部分:按接受质量限(AQL)检索的逐批检验抽样计划》 |
|
GB/T 2829--2002 |
《周期检验计数抽样程序及表》 |
|
GB 3280-2007 |
《不锈钢冷轧钢板》 |
|
GB/T 13810-2007 |
《外科植入物用钛及钛合金加工材》 |
|
GB/T 14233.1-2008 |
《医用输液、输血、注射器具检验方法第1部分:化学试验方法》 |
|
GB/T 14233.2-2005 |
《医用输液、输血、注射器具检验方法 第2部分:生物学试验方法》 |
|
GB/T 16886.1-2001 |
《医疗器械生物学评价 第1部分:评价与试验》 |
|
GB/T 16886.5-2003 |
《医疗器械生物学评价 第5部分:体外细胞毒性试验》 |
|
GB/T 16886.10-2005 |
《医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验》 |
|
YY 0033-2000 |
《无菌医疗器具生产管理规范》 |
|
YY/T 0149-2006 |
《不锈钢医用器械 耐腐蚀性能试验方法》 |
|
YY/T 0245-2008 |
《吻(缝)合器通用技术条件》 |
|
YY/T 0313-1998 |
《医用高分子制品包装、标志、运输和贮存》 |
|
YY/T 0466.1-2009 |
《医疗器械 用于医疗器械标签、标记和提供信息的符号》 |
|
HG/T 2503-1993 |
《聚碳酸酯树脂》 |
|
|
中华人民共和国药典《2010版》 |
|
GB/T12672-2009 |
丙烯腈——丁二烯——苯乙烯 ABS树脂 |
|
GB16331-1996 |
食品包装材料用尼龙6树脂卫生标准 |
上述标准包括了注册产品标准中经常涉及到的标准。有的企业还会根据产品的特点和用途引用一些行业外的标准和一些较为特殊的标准。审评人员应密切关注其合理性。
产品适用及引用标准的审查可以分两步来进行。首先对引用标准的齐全性和适宜性进行审查,也就是在编写注册产品标准时与产品相关的国家标准、行业标准是否进行了引用,以及引用是否准确。可以通过对注册产品标准中“规范性引用文件”是否引用了相关标准,以及所引用的标准是否适宜来进行审查。此时,应注意标准编号、标准名称是否完整规范,年代号是否有效。其次对引用标准的采纳情况进行审查。即:所引用的标准中的条款要求,是否在注册产品标准中进行了实质性的条款引用。这种引用通常采用两种方式,文字表述繁多内容复杂的可以直接引用标准及条文号,比较简单的也可以直接引述具体要求。
注意“规范性应用文件”和编制说明的区别,通常不宜直接引用或全面引用的标准不纳入规范性引用文件,而仅仅以参考文件在编制说明中出现。
如有新版强制性国家标准、行业标准发布实施,产品性能指标等要求应执行最新版本的国家标准、行业标准。
产品具体适用范围与预期用途应与申报产品设计、性能、配置等一致,并有相应的临床评价资料和/或临床试验资料支持。
例如:直线型切割吻合器若预期用于肺切除手术,则吻合器应进行特别的设计确认,以保证组织能被可靠吻合切除。
常见产品的预期用途如下:
1.管型吻合器:主要用于食管、胃、肠等消化道重建手术中消化道的端端、端侧和侧侧吻合。
2.肛肠(痔)吻合器:用于齿状线上黏膜选择性切除。
3.直线型吻合器:主要用于消化道重建及脏器切除手术中的残端或切口的闭合。
4.直线型切割吻合器:主要用于消化道重建及其它脏器切除手术中的吻合口创建及残端或切口的闭合。
5.弧线型吻合器:主要用于术野显露困难的消化道重建及脏器切除手术中吻合口创建及残端或切口的闭合。
1.风险分析方法
(1)在对风险的判定及分析中,要考虑合理的可预见的情况,它们包括:正常使用条件下;非正常使用条件下。
(2)风险判定及分析应包括:对于患者的危害;对于操作者的危害;对于环境的危害。
(3)风险形成的初始原因应包括:原材料选择不当;设计;生产风险;运输与防护不当等;人为因素包括不合理的操作;适用错误、综合危害;环境条件。
(4)风险判定及分析考虑的问题包括:产品原材料生物学危害;产品质量是否会导致使用中出现不正常结果;操作信息,包括警示性语言、注意事项以及使用方法的准确性;留置使用可能存在的危害等。
2.风险分析清单
吻合器产品的风险管理报告应符合YY/T 0316-2008《医疗器械 风险管理对医疗器械的应用》的有关要求,审查要点包括:
(1)产品定性定量分析是否准确(依据YY/T 0316-2008 附录A);
(2)危害分析是否全面(依据YY/T 0316-2008附录D);
(3)风险可接收准则,降低风险的措施及采取措施后风险的可接收程度,是否有新的风险产生。能按运输储存要求对产品进行防护,造成产品破损,污染产品。根据YY/T 0316-2008《医疗器械 风险管理对医疗器械的应用》附录D表E.2初始事件和环境示例对“吻合器”已知或可预见的风险进行判定,产品在进行风险分析时至少应包括以下的主要危害,企业还应根据自身产品特点确定其他危害。针对产品的各项风险,企业应采取应对措施,确保风险降到可接受的程度。
表2 产品主要风险示例
|
风险类别 |
具体示例 |
|
设计不当风险 |
吻合器机械系统设计不当,器身及吻合钉材料选择不当,导致不能有效切割或吻合。 |
|
生物相容性风险 |
选用不适当的材料; 灭菌未确认或未按已确认的参数灭菌; 未能按运输储存要求对产品进行防护,造成产品破损,污染产品; 超过有效期使用; 包装不符合要求或老化; 产品零件生锈; 产品重复使用导致患者受到感染和/或手术失败; 使用完后,未按医疗垃圾处理; 未按要求对生产环境进行控制; 零部件未按要求清洗; 清洗用水不符合要求。 |
|
制造过程风险 |
采购不当;零部件加工精度不当,部件互换性差;装配调整不当;不合格品未被检出;发生缺钉/掉钉现象;包装不当;灭菌有效性未被充分确认/验证。 |
|
运输和贮藏风险 |
不恰当的包装;污染;防护不当运输中吻合钉脱位/脱落;贮藏环境不当。 |
|
处置和废弃风险 |
没提供信息或提供信息不充分;错误使用。 |
|
使用风险 |
明示应由经培训的专业人员使用;组件大小选择不当,造成使用错误。 标记:包装标记不当,如会产生重复使用的危害,引起交叉感染; 对一次性使用的医疗器械很可能再次使用的危害警告不适当,造成重复使用; 不完整的使用说明书,造成操作错误; 性能特征不恰当的描述,造成错误使用; 不适当的预期使用规范,造成错误使用; 操作说明书的遗失,造成错误使用; 所用附件规范不适当,造成错误使用; 非预期使用; 使用者未按规范程序使用。 |
|
其它风险 |
漏装钉; 未在吻合区进行吻合; 吻合钉成形不良; 严重粘膜水肿; 管壁肌层过厚或过薄; 缝钉机械性能不符合要求; 材料强度小; |
本条款给出吻合器需要考虑的基本技术性能指标,其中对产品的技术要求主要参照YY/T 0245-2008《吻(缝)合器通用技术条件》。此外企业可参考相应的国家标准、行业标准,根据企业自身产品的技术特点制定相应的要求。以下如有不适用条款(包括国家标准、行业标准要求),企业在注册产品标准的编制说明中必须说明理由。
1.外观
(1)吻合器外表光滑、无锋棱、毛刺及裂纹,器身上的刻度值或标识应清晰。
(2)吻合器壳体的粘合(或焊接)应牢固,不得有裂缝和明显堆积物。
(3)吻合钉钉头应尖锐,表面不得有凹痕、划伤等缺陷;切割刀应锋利,不得有卷刃、崩刃。
2.尺寸
吻合器的尺寸应符合注册产品标准中的规定。
3.材料
应明确参照YY/T 0245-2008《吻(缝)合器通用技术条件》或相关国家标准、行业标准要求写出吻合器的全部制作材料及其材料标准(包括吻合钉)。
4.使用性能
(1)吻合器的组件与器身架应能顺利地装配和拆卸;各移动部位应能顺利推动,不得有卡住、松动现象;组件装入器身应牢固,吻合钉不得脱落变形。
(2)吻合器的保障机构(释放钮、关闭柄)开闭应灵活,使用应安全。弹簧应有足够弹性,当松开手柄时能迅速复位。
(3)吻合钉头端应尖锐;切割刀应锋利,不得有卷刃、崩刃。
5.硬度要求
采用20Cr13材料制成的部件应经热处理,其硬度为40HRC-48HRC;切割刀的硬度应不低于377HV0.2。(制造商也可根据自己产品的性能制定部件和切割刀的硬度,但是需要提供完整的验证资料予以证明)。
6.表面粗糙度:吻合器外露金属表面粗糙度Ra≤0.8μm。
7.耐腐蚀性能:重复性使用吻合器切割刀、抵钉座的耐腐蚀性能应符合YY/T0149中5.4 b级的规定
8.一次性吻合器包装封口剥离强度:吻合器封口剥离强度应在0.1-0. 5(N/mm)范围内,被撕开的两接触表面应光滑且连续均匀无分层或撕裂现象。
9.灭菌:一次性使用吻合器及组件经已确认过的灭菌过程进行灭菌。
10.环氧乙烷残留量:如采用环氧乙烷灭菌,一次性使用吻合器及组件的环氧乙烷残留量应不大于10 μg/g。
11.生物学评价
(1)表面作改性处理(包括表面涂层、酸蚀及其他表面处理)的纯钛、钛合金材料和纯钽材料制成的吻合钉的生物学评价应符合GB/T 16886.1的规定。
(2)吻合器及组件的细胞毒性应不大于1级。
(3)吻合器及组件迟发型超敏反应的等级应不大于1。
(4)吻合器及组件皮内反应的计分应不大于1。
12.吻合口的耐压要求
经吻合器缝合后的缝合口应能承受不小于3.6kPa的压力,不得有漏水和撕裂现象
13.吻合器附件(若有)要求:应分别列出附件的材料、尺寸、性能要求;此外根据不同材料特性,由企业决定是否对吻合器及组件的化学性能提出要求。
产品的检测包括出厂检验和型式检验。出厂检验应根据产品特点要求,至少应包括外观、尺寸、使用性能、吻合口耐压(按规格大中小抽样)、表面粗糙度、无菌、环氧乙烷残留(若有)等。国家标准或行业标准对出厂检测项目有要求的,按要求执行。
型式检验应为产品标准全性能检验。
1.临床试验机构应为国家食品药品监督管理局认定公布的临床试验基地。临床试验应按照《医疗器械临床试验规定》及《医疗器械注册管理办法》附件12的要求进行,同时应注意以下要求:
(1)确保受试人群、受试部位具有代表性,充分考虑成人与小儿、均匀组织与不均匀组织的差别。
(2)明确产品种类、规格以及在临床试验中的预期用途。
(3)试验持续时间应根据受试者的状况和产品预期用途以及统计学的要求确定。
(4) 临床对照一般采取随机同期对照的方式,即受试者随机分配至试验组和对照组,同期进行临床试验,最后将结果进行比较。应明确对照产品注册证号、生产厂家等信息。
(5)应明确进行临床研究的科室、临床负责人、参与者等信息。
2.若提交同类产品临床试验资料或临床文献资料的医疗器械,则应满足《医疗器械注册管理办法》附件12的要求。
根据文献记载,吻合器产品在临床中出现的不良事件主要有:出血、吻合口漏、吻合口狭窄、局部组织坏死等。鼓励制造商积极收集并全面分析上报吻合器相关可疑不良事件。
产品说明书、标签和包装标识的编写要求应符合《医疗器械说明书、标签和包装标识管理规定》和《医疗器械 用于医疗器械标签、标记和提供信息的符号》(YY/T 0466.1-2009)的要求。同时应注意以下要求:
1.根据临床试验资料、专家审评意见等有关技术文件,明确产品的适用人群(成人、小儿等)、适应症和禁忌症;
2.对产品使用方法,尤其是带有安全保障系统的,如防止二次击发的机关,如何使用应进行详细说明;
3.对应用部位(组织器官)进行说明;
4.应提示对产品材料过敏者禁用;
5.应提示一次性使用(若是),用后销毁,包装如有破损,严禁使用;
6.应提示灭菌方式(若以无菌形式提供);
7.其他必要的警示:如仅供经培训的专业人员使用和严禁二次使用等。
1.产品的注册单元以技术结构、性能指标和预期用途为划分依据。
2.用于同一台手术中可更换的组件,可以作为一个注册单元。
例如:
重复使用的吻合器及组件与一次性使用的吻合器及组件应分别作为独立的注册单元;
用于腹部手术的管型吻合器与用于肛肠的痔吻合器应分别作为独立的注册单元;
直线型吻合器与直线型切割吻合器应作为独立的注册单元;
弧线型吻合器应作为独立的注册单元;
同一预期用途的连体式或分体式管型吻合器可作为同一注册单元;
同一预期用途的器身带刀和组件带刀的直线型吻合器可作为同一注册单元;
同一预期用途的固定间隙和可调间隙直线型切割吻合器可作为同一注册单元。
1.同一注册单元中的典型产品是指能够代表本注册单元内其他产品安全性和有效性的产品。其功能最齐全、结构最复杂、规格型号尺寸最大、风险最高。
2.典型产品的确定可以通过比较同一注册单元内所有产品的技术结构、性能指标和预期用途等相应资料,说明其能够代表本注册单元内其他产品的安全性和有效性。
举例:
一次性使用管型吻合器及组件:连体式和分体式中规格最大、钉数最多者;
一次性使用直线型吻合器及组件:器身带刀和组件带刀中规格最大者。以此类推。
三、审查关注点
(一)申报产品的规格型号是否能满足一个注册单元要求,申报事项是否准确,命名是否合理。
(二)产品技术报告应按国家食品药品监督管理局对境内第二类医疗器械注册审批的要求编写。重点关注制作材料的选择和依据、结构组成描述应完整(尤其要包括全部选配件和附件如扩肛器等)、外购和自制部件明确说明、结构性能和作用机理和临床一致、主要技术指标符合YY/T 0245-2008《吻(缝)合器通用技术条件》要求,如有其他增设和删减必须提供科学依据、工艺流程应规范。重新注册的产品应该详细准确说明与上次注册的变化和原因及依据。
(三)安全风险管理报告要审查产品的主要风险(包括设计、材料、加工途径、灭菌、使用等方面)是否已经列举,控制措施是否有效,风险是否降到可接受的程度之内。
(四)产品注册标准编写的规范性,引用标准的适用性、准确性,内容是否符合YY/T 0245-2008《吻(缝)合器通用技术条件》及有关标准的要求。
(五)产品性能自检报告、型式检验报告的完整性,按标准要求应检项目不得缺项,检验结论及意见等。
(六)产品预期用途,从医疗器械注册申请表、技术报告、安全风险管理报告、产品使用说明书、实质性等同产品、临床文献等方面叙述的是否一致。
吻(缝)合器产品注册技术
一、指导原则编写目的
本指导原则编写的目的是用于指导和规范第二类吻合器产品注册申报过程中审查人员对注册材料的技术审评。
本指导原则旨在让初次接触该类产品的注册审查人员对产品机理、结构、主要性能、预期用途等各个方面有个基本了解,同时让技术审查人员在产品注册技术审评时把握基本的尺度,对产品安全性、有效性做出系统评价。
(一)《医疗器械监督管理条例》;
(二)《医疗器械注册管理办法》(局令第16号);
(三)《医疗器械临床试验规定》(局令第5号);
(四)《医疗器械说明书、标签和包装标识管理规定》(局令第10号);
(五)《医疗器械标准管理办法》(局令第31号);
(六)关于印发《境内第二类医疗器械注册审批操作规范(试行)》的通知(国食药监械[2005]73号);
(七)国家食品药品监督管理局发布的其他规范性文件;
(八)YY/T 0245-2008《吻(缝)合器通用技术条件》。
(一)关于产品适用范围
目前临床使用的具备“机械吻合和缝合”性能的器械种类繁多。有些产品如管型吻合器、直线型吻合器、直线型切割吻合器等在设计、生产和临床使用环节近五年来已进入相对成熟的阶段,生产企业较多、生产量较大、临床使用日益广泛。目前临床同样较广泛使用的皮肤缝合器(含拆钉器)因结构、功能殊于吻合器,其产品不宜与吻合器同列。腔镜下使用的吻合器及血管吻合器目前尚处于临床使用早期阶段,其产品设计、技术要求与生产、使用均殊于常规手术中使用的吻合器,其产品技术审查指导原则宜单独编写。基于以上原因,本指导原则只适用于产品设计(材料、结构等)、生产工艺、技术性能和预期用途已相对成熟的“管型吻合器、直线型吻合器、直线型切割吻合器和弧(线)型吻合器”等产品。
(二)关于产品及部件名称
“吻”与“缝”在临床手术中具有不同的含义:“吻”通常指将两个腔体在断端处接合,形成一个新的通道; “缝”通常指将两个残端闭合。本指导原则适用的产品有些兼具“吻、缝”功能,有些只有“吻”或“缝”一个功能。兼顾临床使用习惯和行业标准的命名方法,本指导原则将“吻合器”改成了“吻(缝)合器,简称吻合器。
在编写“产品名称要求”一节时,经调查,管型吻合器命名较统一,线性、线性切割、弧形与痔吻合器命名不统一。线性、线性切割吻合器名称参考了行业标准《直线型吻合器及组件》(报批稿)、《直线型切割吻合器及组件》(报批稿),弧型吻合器命名参照了行业标准的命名法并与其保持统一。 痔吻合器是管型吻合器的一种,本指导原则的命名体现了这种吻合器的适用部位,也是市场上这类产品最常用的名称。
本指导原则适用的吻合器通常由主要由钉砧、吻切组件器身(包括手柄)三部分构成。不具备切割功能的习惯称为钉仓。吻合器行业标准中未将钉仓与组件加以区分。本指导原则统一采用“组件”一词。“组件”与“钉仓”、“钉仓组件”可以互换。
参照行业标准《直线型吻合器及组件》(报批稿)、《直线型切割吻合器及组件》(报批稿),“缝钉”统一称为“吻合钉”。
(三)关于产品作用机理
吻合钉在穿过两层组织后受到前方钉砧的阻挡,向内弯曲,除可形成“B”形钉合外,还可形成其他钉形。目前市场上绝大多数的吻合器为“B”形钉合。本指导原则因未研究其他钉形吻合器的结构,故未将能形成其他钉形的吻合器列入适用范围。
(四)关于吻合钉的材料
目前市场上常用的吻合钉材料有医用不锈钢、纯钛、钛合金与纯钽等。可用于吻合钉的材料还包括其他金属材料,甚至可降解金属材料。本指导原则鼓励制造商使用经过验证的并被评价为安全的新材料,以提升产品性能。
(五)关于产品的主要技术指标
由于YY/T 0245《吻(缝)合器通用技术条件》最早为重复使用的吻合器编制,2008版虽经修订,仍未充分、合理反映一次性使用吻合器的产品特点及要求,部分检验方法存在缺陷。本指导原则在编制“产品主要技术指标”时,充分综合了行业标准YY/T 0245-2008《吻(缝)合器通用技术条件》要求。
由于吻合器是一类具有较高风险的精密手术器械。既使同一型号不同规格的吻合器也具有系统独立性,因此设计确认就显得尤为重要。
(六)关于产品的预期用途
本指导原则中的“产品预期用途”一节综合了已批准上市产品的核准范围及临床专家的意见。但由于不同制造商所做的设计确认工作及临床评价/临床试验工作不同,具体产品的核准预期用途仍需审核员经综合系统评估后核定。
(七)关于审查关注点
吻合器是一种精密匹配的机械系统,可量化、可测量的技术性能指标有限,设计、生产、使用过程中可供确认的方法不多。如果吻合器设计、生产、使用不当,可能造成患者出现出血、渗血、吻合口狭窄、吻合口漏等,严重时可造成患者死亡。因此审核员应充分关注吻合器的各类风险。本指导原则提供了一个吻合器审核关键点的清单,涉及技术报告、风险管理报告、注册产品标准、出厂检测与型式检测、产品使用说明书等文件,还涉及产品设计及设计变更、生产、售后服务等环节,供审核员参考。
本指导原则的编写成员由江苏省食品药品监督管理局医疗器械产品注册技术审评人员和行政审批人员、江苏省医疗器械检验所专家、专业厂家代表、临床专家共同组成,以充分利用各方面的信息和资源,综合考虑指导原则中各个方面的内容,尽量保证指导原则正确、全面、实用。