接触镜护理产品注册技术审查指导原则
一、前言
接触镜护理产品用于对接触镜进行科学的护理与保养,以维持接触镜功能,并保障使用者安全、舒适与顺利配戴。
本指导原则系对接触镜护理产品的一般要求,申请人/生产企业应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用。
本指导原则是对申请人/生产企业和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,需要提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行调整。
二、适用范围
本指导原则适用于指导接触镜护理产品注册申报资料的准备,同时也为食品药品监管部门对申报资料的审评提供技术参考。
本指导原则是针对接触镜片的护理产品,适用于各类具有接触镜的清洁、消毒、冲洗、浸泡、保存、润滑等之一或以上作用的护理产品。目前主要包括了专用于接触镜护理的生理盐水、清洁剂、接触镜化学消毒产品、多功能液、配戴接触镜中应用的润滑液。
技术报告是申报资料的基础,通过技术报告可以详细迅速地了解产品概况,包括产品的研发思路、生产过程、各项性能指标的确定依据等重要内容,为产品设计的合理性、产品安全性提供初步判断的依据。接触镜护理产品申请人/生产企业对研发接触镜的便捷护理程序应慎重考虑。
接触镜护理产品的技术报告应该包括法规对技术报告的通用要求内容,重点关注产品活性成分,但是在评估产品活性成分的同时,还应该评估产品的非活性成分(例如:缓冲液)带来的影响。评估因素包括:接触镜护理产品与镜片的相容性、生物相容性、主要有效成分(其中表面活性剂浓度可由临界胶束浓度替代)、抗微生物活性、防腐有效性、无菌性、pH值、溶液渗透压等。在此基础上重点体现如下信息并提供相关支持信息描述的技术资料:
1.基本信息:
(1)护理产品的名称、规格(体积或重量)及型号的描述。
(2)各护理产品的用途,其适用的接触镜材料类型(具体参照国家标准)的描述。
(3)护理产品使用方法的描述。对每种护理产品的使用步骤应有详细的描述。
(4)国内外同类产品动态分析:提供申报产品与类似产品的组分对比数据。
2.明确产品的配方、各组分对应功能。提供产品原材料的信息(如材料来源、质量控制标准等)。申请人/生产企业应提交相关资料以说明各组分的安全性、有效性,如组分特征数据和/或用于临床试验产品批次的有关分析结果,材料安全性数据表等。如果组成成分符合中华人民共和国药典, 或医疗器械国家标准和行业标准的规定,应有相应说明。如果组成成分包含药物成分或动物源性的原材料应参照相应指导原则提交资料。
3.对制造过程进行相应描述,包括流程图。介绍产品生产过程,包括各种加工工艺(注明关键工艺及参数),提供产品生产过程的确定依据以及涉及到的研究性资料、文献资料。
4.描述产品采用的包装容器材料和规格,是否采取了合理的保护措施,防止使用中的污染。采用的产品包装容器材料应通过毒理学评价试验,提供其质量控制标准及选择包装容器材料的安全性证明资料。
5.无菌:对以无菌方式提供的接触镜护理产品,申请人/生产企业需要对用于保证产品无菌的质量保证体系和灭菌方法进行描述并提供相应验证资料。如果灭菌过程使用了环氧乙烷(EO),必须提供产品或产品包装的EO最大残留量的验证资料。
6.微生物限度检验:对以非无菌方式提供的接触镜护理产品,申请人/生产企业需要提供微生物限度检查数据,以保证产品符合YY0719.2《眼科光学 接触镜护理产品 第2部分:基本要求》中微生物的要求。
7.对有消毒功能的护理产品,应提供抗微生物活性的技术资料。
8.防腐有效性:含有防腐剂的护理产品,申请人/生产企业必须提供产品在有效期内的防腐有效性的验证资料。
9.开封产品抛弃日期:含有防腐剂的护理产品,申请人/生产企业必须提供产品开封抛弃日期的验证资料。
10.提供产品有效期(稳定性)验证数据:申请人/生产企业在申报产品注册时需要提供产品有效期的验证报告(包括:涉及产品性能稳定与无菌持续状态的保证期限)及内包装材料信息。
11.在推荐护理方案下的溶液与接触镜镜片相容性:镜片的类型可表明产品的特定用途,对不同类型的镜片与护理液的相容性需要进行评估。
12.防腐剂的吸收/释放:如果接触镜用护理液中含有防腐剂,需要提供防腐剂吸收/释放的技术资料。尤其在产品含有在护理产品中未使用过的防腐剂时,申请人/生产企业需要评估非活性成分(例如缓冲剂等)对防腐剂吸收/释放的影响。
13.提供产品生物学评价资料。
根据YY/T0316《医疗器械 风险管理对医疗器械的应用》,对接触镜护理产品的原材料、生产加工过程、产品包装、灭菌、运输、贮存、使用等产品寿命周期的各个环节,从能量危害(若涉及)、生物学危害、环境危害、有关使用的危害、由功能失效和维护及产品老化引起的危害等方面,进行风险分析,详述所采取的风险控制措施。
根据《医疗器械标准管理办法》(试行)的要求,注册产品标准应符合国家标准、行业标准和有关法律、法规的要求。在此基础上, 生产企业应根据产品的特点,参照《无源植入性医疗器械产品注册申报资料指导原则》相关要求制定保证产品安全有效、质量可控的技术要求。注册产品标准中技术要求及试验方法均应经过相应验证。
一般情况下根据产品的稳定性(可参考YY0117.6《眼科光学 接触镜护理产品 第6部分:有效期测定指南》),选择风险最大的产品规格(可不局限于一种规格)进行注册检测,如同一产品不同规格的有效期不同,则应分别送检。
对于按照《医疗器械注册管理办法》规定需要在国内进行临床试验的注册申报项目,临床试验应符合国家食品药品监督管理局颁布的《医疗器械临床试验规定》及其他相关法律、法规的规定,同时参考本指导原则制定临床试验方案并实施。
接触镜护理产品的临床资料应评价和确认接触镜护理产品的临床安全性、有效性;研究接触镜护理产品对所适用类型接触镜镜片是否达到安全有效的护理和保养,护理产品与镜片的相容性以及对眼部产生的影响;针对接触镜护理产品新开发的功能进行临床试验观察。
1.适用范围
适用于接触镜的清洁、消毒、冲洗、浸泡、保存等。适用的接触镜种类及护理产品功能应根据具体申报产品特点进行明确规定。
2.临床试验方案
临床试验方案设计中应重点考虑以下方面:
(1)设置合理对照组
目前凡在我国申请上市、按法规需要进行临床试验的接触镜护理产品,进行临床试验时均应设立对照组,对照产品应是我国已经批准上市的同类产品,对照组与试验组的适用镜片应相同。对于临床上无同类产品的创新型产品,应采用临床常规的镜片护理产品及方法作为对照。
(2) 临床试验病例数(样本量)评价
接触镜护理产品的有效性、安全性的评估均应采用临床上通用的评价标准。临床试验持续时间须不少于3个月,每个评价病例应该是完整的双眼数据,临床试验最终完成总样本量不少于120例,按1:1设置对照,试验组不少于60例。根据现行《医疗器械临床试验规定》,临床试验应当在两家以上(含两家)医疗机构进行。
3.试验组和对照组需采用统一的入选标准和排除标准,其标准的具体内容由临床试验负责单位具体讨论决定。
4.临床试验观察项目及常规疗效评价指标
(1)屈光状态:裸眼视力、最佳矫正视力、屈光度。其中视力可利用我国标准对数视力表检查志愿者的裸眼及各种矫正远视力、近视力并进行记录(小数或对数)。应提供受试者戴镜前、后的屈光度变化(球镜度及柱镜度)。
(2)眼部情况:在临床试验期间要求定期随访观察眼部的变化,包括:泪液膜、结膜、角膜、前房、晶状体、眼底、眼压等,在试验期间需严密监控并记录临床并发症的发生,随访次数由试验负责单位设计确定,原则上不能少于三次。
(3)接触镜配适状态:初次配戴及定期随访中需观察镜片在眼表的位置(中心定位)、松紧度、活动度、荧光染色(硬性透气性接触镜适用),并评价与记录其等级。
(4)测试护理液和镜片:定期随访中观察镜片的污损情况,观察镜片有无沉淀、变形、变色、锈斑、划痕、破损等,护理液有无混浊、杂质、沉淀等。
(5)安全性评价:
① 受试者的眼部不良反应
② 医生诊断的眼部并发症
③ 镜片的异常改变
目前接触镜护理产品的临床常规疗效评价指标可参见附录Ⅰ和附录Ⅱ。
5.随访时间点及方法
分别于使用后1周、1个月、3个月进行随访(结合试验具体情况可设定更为频繁的观察时间),在随访中对接触镜护理产品的有效性、安全性、舒适性等方面进行评估(随访内容可参见附录Ⅲ)。
6.临床试验报告
(1) 临床试验报告内容应与临床试验方案内容保持一致,尤其注意明确以下内容:试验产品的产品名称、规格型号及所对应的试验病种和各个病种的病例数;试验产品的临床适用范围/适应症、禁忌症与注意事项。
(2) 临床试验报告中应明确失访例数及失访原因。
(3) 临床试验报告中需报告所有不良事件和不良反应发生的时间、发生的原因、结果及与试验用品的关系。对于所采取的措施及受试者的愈后需予以明确记录说明。
(4)临床试验报告中应明确临床试验结论。
必要时要随临床报告同时提交用于统计分析的数据库。
1.为全面了解已注册产品临床使用情况,申请人/生产企业应在质量跟踪报告中提供已注册产品市场销售情况,包括产品销售量;如果产品型号间差异较大时,应提供不同型号产品销售情况。
2.根据产品临床适用范围/适应症,详述产品上市后临床随访情况。
3.详述产品上市后所有不良事件、投诉发生情况,对不良事件、投诉原因分析与处理情况。
4.为了对重新注册产品的安全性和有效性做出科学合理的评价,申请人/生产企业应详细说明此次申请重新注册产品与原注册产品相比的任何变化情况。可能涉及但不限于以下几个方面:
(1)材料及材料供应商
(2)加工工艺
(3)产品配方
(4)适用范围/适应症
(5)包装材料
(6)灭菌方式
(7)使用方法
若存在任何一种涉及产品技术性的变化,则申请人/生产企业需要提交该变化是否会带来新风险的详细论证资料。
根据《医疗器械说明书、标签和包装标识管理规定》的要求提供产品说明书,此外还应注意以下内容:
1.包装
应符合GB19192《隐形眼镜护理液卫生要求》第7款和YY0719.2 《眼科光学 接触镜护理产品 第2部分:基本要求》第14款的要求,包装应具完整性和密封性。
2.说明书和标签
从所有接触镜配戴者的切身利益出发,为了更好的促使配戴者按规范程序进行安全护理,保证眼部健康卫生,接触镜护理产品的使用说明书/标签应突出强调接触镜护理的重要性,为接触镜的正确护理提供具体指导。
(1)标签和说明书
应符合GB19192《隐形眼镜护理液卫生要求》第7款要求和YY0719.2 《眼科光学 接触镜护理产品 第2部分:基本要求》第16款的要求。
(2)说明书中应告知配戴者,由专业眼科医师和专业技术人员确定配戴者是否适宜验配接触镜并使用相应护理产品。同时应明确告知配戴者一旦出现眼部不适情况,应立即停止使用并及时就诊。
(3)告知验配者验配前需认真询问病史,详细进行眼部检查、医学验光,结合每个人的个体情况、生活及工作环境条件,确定接触镜处方及护理产品。验配后详细为配戴者讲解镜片及护理产品的使用方法,镜片清洁护理的原则、方法,指导其摘、戴镜片,并强调戴镜及使用护理产品的注意事项、定期随访的重要性,制定定期复查计划。
(4)考虑到可能存在的污染物问题、使用者不合理使用或易混淆的问题,接触镜多功能护理液的说明书不能标注此类产品为眼内使用溶液或可在接触镜配戴时润滑和/或湿润镜片。
(5)目前,对于接触镜护理产品中的接触镜多功能护理液,不建议申请人/生产企业在说明书中宣传免揉搓功能,而应在说明书中特别增加要认真揉搓镜片的提示,重点强调使用多功能护理液揉搓和冲洗接触镜是一种有效的镜片护理方式,能够明显减少微生物感染的危害。
1.接触镜(contact lens):设计用于配戴眼球前表面的眼科镜片。
2.临界胶束浓度(critical micelle concentration):表面活性剂分子在溶剂中络合形成胶束的最低浓度即为临界胶束浓度。
3.活性成分(active ingredient):又称有效成分,指能使接触镜护理产品达到预期目的配方中的化学成分(如:抗微生物剂、防腐剂、酶、表面活性剂、保湿剂等)。
1.《医疗器械监督管理条例》(中华人民共和国国务院令第276号)
2.《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)
3.《医疗器械临床试验规定》(国家食品药品监督管理局令第5号)
4.《医疗器械说明书、标签和包装标识管理规定》(国家食品药品监督管理局令第10号)
5.YY/T 0316-2003《医疗器械 风险管理对医疗器械的应用》
6.FDA, Guidance Document for contact lens care products, 2006.11
7.ISO 11980:1997 Ophthalmic optics — Contact lenses and contact lens care products— Guidance for clinical investigations
8.YY0719.1-2009《眼科光学 接触镜护理产品 第1部分:术语》
9.YY0719.2-2009《眼科光学 接触镜护理产品 第2部分:基本要求》
10.YY0719.3-2009《眼科光学 接触镜护理产品 第3部分:微生物要求和试验方法及接触镜护理系统》
11.YY0719.4-2009《眼科光学 接触镜护理产品 第4部分:抗微生物防腐有效性试验及测定抛弃日期指南》
12.YY0719.5-2009《眼科光学 接触镜护理产品 第5部分:接触镜和接触镜护理产品物理相容性的测定》
13.YY0719.6-2009《眼科光学 接触镜护理产品 第6部分:有效期测定指南》
14.YY0719.7-2009《眼科光学 接触镜护理产品第7部分:生物学评价试验方法》
一、结膜观察
(一)睫状充血
可按下列分级
0级 正常 无充血
1级 轻度 轻度睫状充血(角膜周边轻度整体充血)
2级 中度 明显睫状充血(明显的局限性充血)
3级 重度 严重的睫状充血(角膜周边严重充血)
(二)球结膜充血
可按下列分级
0级 正常 无充血
1级 轻度 轻度弥漫性充血
2级 中度 明显的局限性或弥漫性充血
3级 重度 弥漫性的巩膜浅层充血
(三)球结膜镜片压迹/凹陷:0为无,1为有。
(四)睑结膜观察
结膜最大反应位置可按下述分级记录:
0级 正常 结膜面均匀光泽
1级 轻度 直径小于1mm的轻微或散在的乳头或滤
泡
2级 中度 a)直径小于1mm的明显乳头或滤泡
b)1个乳头顶端染色
3级 重度 a)直径1mm或以上局限性或弥漫性的
乳头或滤泡
b)1个以上乳头顶端染色
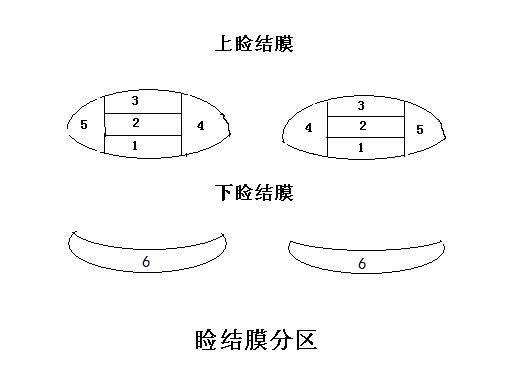
另外,结膜反应按六个眼睑区域分别记录:
上眼睑:
1 = 上睑结膜
2 = 中睑结膜
3 = 下(框缘区域)睑结膜
4、5 = 内、外眦睑结膜
下眼睑:
6 = 下眼睑的睑结
二、 角膜观察
(一)角膜水肿
1.上皮水肿
0级 正常 无水肿,角膜清晰透明
1级 轻度 上皮轻度雾状混浊
2级 中度 明显的局部或整体上皮雾状混浊
3级 重度 广泛的上皮云雾状混浊,可能出现大泡
大泡的存在与否必须说明,同时说明它们的数量。出现大泡必须看作可报告的4级严重上皮水肿。
2.基质水肿
基质水肿可按下列分级:
0级 正常 无水肿
1级 轻度 轻度角膜中心混浊,瞳孔边缘清晰可
2级 中度 角膜混浊,瞳孔边界模糊可见或有后弹
力层皱折
3级 重度 角膜中心混浊,瞳孔边界不可见出现明
显后弹力层皱褶
(二)角膜上皮微囊
0级 无 裂隙灯后部反光照射下未发现微囊泡
1级 轻度 中心或旁中心区角膜少量微囊,少于30
个,表面无染色和其他异常
2级 中度 多量微囊出现,多于30个,并有融合,
可伴有明显染色或干燥斑
3级 重度 大量微囊出现,大于50个,并融合成片,
伴有明显染色或上皮糜烂
(三)角膜内皮多形性变化(图1)
0 级 无 年龄段正常值(40岁以下),细胞密度高
(通常高于2500/mm2),大小均匀,规则
六角形内皮镶嵌,CV值(形态变异系数)
<25,六角形细胞比率>65%
1 级 微度 偶有个别内皮细胞增大,CV 值 25~28
六角形细胞比率<65%
2 级 轻度 个别内皮细胞增大,形态仍较规则, CV
值>30 ,六角形细胞比率<60%
3级 中度 内皮细胞增大,密度有所降低,细胞大
小分布不均匀,形态不规则,CV值 >35,
六角形细胞比例下降<55%
4级 重度 内皮细胞明显增大,密度明显降低(低于
2000/mm2),大小显著不同,形态极不规
则,CV值>40, 六角形细胞比例明显下
降<50%

图1 角膜内皮细胞多形性改变分级
(四)角膜新生血管形成
角膜新生血管按血管伸入角膜透明区的范围分级:
0 = 无 无血管延伸
1 = 微度 <1mm血管延伸
2 = 轻度 ≥1mm至≤1.5mm血管延伸
3 = 中度 >1.5 mm至≤2mm血管延伸
4 = 重度 血管延伸>2mm
另外,血管延伸的深度和位置可做下述报告:
深度: a)表层
b)基质层
位置:N鼻侧 T颞侧
I下方 S上方
C全周 X其他的(需具体描述)
(五)角膜荧光染色
角膜染色可按下列分值记录(见其下的注1和2)
0级 正常 无染色
1级 微度 仅限于浅表上皮的点状染色
a)散在点状染色包括微凹染色
b)范围≤15%
2级 轻度 局部或散在点状染色
a)中央的或聚集的,或
b)周边染色,包括3、9点范围内的染色或
c)大点状,16%—30%,可波及深层上皮,缓慢轻度基质着色,明亮
3级 中度 最大直径超过2 mm的密集团块状染色
a) 角膜擦伤
b) 大点融合状,31%—45%,深层上皮,快速局限性基质着色,明亮
4 级 重度 直径超过2mm的密集团块状染色。片状,
>45%,深层上皮,快速弥漫性基质着色,
明亮
观察到的染色位置应以下述方式记录,记录位置的优选方式是使用数字标定(见图2)。
注1:应使用观察系统中的钴蓝光和黄色滤光镜来观察所有角膜染色。
注2:应在“其他并发症”部分中记录反复性糜烂和溃疡位置:
1或C 中心的 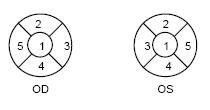
2或S 上方 图2记录染色位置方法的示例
3或N 鼻侧
5或T 颞侧
4或I 下方
(六)角膜浸润
角膜点状浸润可按下列分级:
0级 正常 无浸润
1级 微度 少于5个点状浸润
2级 轻度 大于5个少于8个点状浸润
3级 中度 > 8个点状浸润
4级 重度 出现片状浸润或深基质浸润
(七)角膜的其他损害
1.角膜糜烂:局部全层角膜上皮细胞缺损。
2.周边角膜溃疡:呈圆形,在炎症浸润的基础上全层上皮缺损,位于角膜周边区。
3.感染性角膜溃疡:明显充血,全层角膜上皮缺失,基质炎症和坏死,位于角膜的中央区或旁中央区。
一、概述
临床方案如包括这些程序,应考虑下述分类。
二、视觉性能
为评价视觉性能,应测量视力。
另外,在有眩光光源时,也应测试低对比的视力、对比敏感度和视觉性能。
三、屈光性能
应提供受试者戴镜前、后的屈光度变化(球镜度及柱镜度)。
四、角膜散光测量
应记录受试者角膜强弱主径线曲率及角膜散光度和散光轴位的结果。
五、 接触镜的配戴特性
(一)概述
可使用下述分类评价接触镜眼内配戴特性,按接触镜的配适状态可分为软性接触镜和硬性接触镜。
(二)镜片中心定位
镜片在角膜上的稳定位置,应按如下3分值记录:
0 = 最佳镜片中心定位
1 = 可接受的非中心定位
2 = 不可接受的非中心定位
(三)镜片移动
应记录镜片的移动。
眨眼后立即记录相对于镜片的基础位置的镜片移动。
下睑上推,镜片复位运动的结果,用下列数字记录:
-2 = 不可接受的移动过小
-1 = 可接受的移动过小
0 = 最佳移动
+1 = 可接受的过度移动
+2 = 不可接受的过度移动
(四)镜片的荧光素染色情况(硬性透气性接触镜适用)
-2 = 不可以接受的陡峭配适
-1 = 可以接受的陡峭配适
0 = 平行配适
+1 = 可以接受的平坦配适
+2 = 不可以接受的平坦配适
六、 镜片表面特性
(一)前表面湿润度
0 = 反射面光滑均匀
1 = 表面粗糙模糊,在每一眨眼瞬间看起来清晰,凝视时变得模糊
2 = 表面有局限性干燥斑(不湿润)
3 = 镜片表面不湿润
(二)前表面沉淀物
0 = 无 表面清洁
1 = 微度 仅在泪液干燥后可见
2 = 轻度 易去除的可见沉淀物
3 = 中度 不可去除的沉淀物
4 = 重度 不可去除的沉淀物,影响舒适度
(三)后表面沉淀物
0 = 无 表面清洁
1 = 微度 3点或更少的可去除微粒
2 = 轻度 最多至10点的可去除微粒
3 = 中度 3点或更少的不可去除沉积
4 = 重度 4点或更多的沉积物和(或)角膜压迹
七、 主观可接受程度
(一)舒适度
0 = 疼痛, 不能接受镜片
1 = 非常不舒服,有强烈刺激或不耐受
2 = 轻微不舒服,有刺激性或不耐受
3 = 舒适,有镜片存在感但无刺激感
4 = 非常舒服,偶有镜片存在感
3 = 极佳,无镜片存在感
(二)视觉
0 = 不可接受,镜片不能配戴
1 = 很差,视力不良,不可接受
2 = 差,视力模糊,但可接受
3 = 好,偶尔视力模糊,但可接受
4 = 很好,轻微视物模糊,可接
5 = 极佳,无视觉模糊
(三)可操作性
0 = 极差, 不能对镜片操作
1 = 很差,有困难和非常偶尔才能成功戴上和取出
2 = 差,有困难,偶然地戴上和取出成功
3 = 好,有一些问题,但通常能成功地戴上和取出
4 = 很好, 偶尔有镜片戴上和取出困难
5 = 极佳,镜片的戴上和取出没问题
(四)对镜片的清洁性
0 = 极差,不能清洁镜片
1 = 很差,基本不能清洗干净镜片
2 = 差,有困难,偶然清洁困难
3 = 好,有一些问题,但通常能清理干净镜片
4 = 很好, 偶尔有清洁困难
5 = 极佳,镜片处理很干净
附录Ⅲ 常规随访时间和内容
|
随访时间 |
评 估 项 目 |
||||||
|
随访1: 配镜前基本检查和护理产品及镜片发放 |
裸眼视力 |
矫正视力 |
眼科常规检查:裂隙灯检查(角膜、结膜、泪液膜),眼底检查,和眼压检查等。 屈光状态检查。护理产品过敏反应等。 |
护理产品包装、外观、及物理性状检查。镜片参数和质量确认 |
配适状态检查:静态和动态评估配适状态 |
首次使用护理产品后自觉症状调查评分 |
按测试需求填写其他检查项目 |
|
随访2: 配镜和用护理产品后1周 |
矫正视力(需要时进行追加矫正) |
裂隙灯检查:角膜、结膜、泪液膜 |
镜片观察:清洁度、污损、沉淀、变形、变色、锈斑、划痕、破损等护理液观察:混浊、杂质、沉淀等 |
同上随访1 |
使用护理产品后自觉症状调查评分 |
其他特殊 检查项目 |
|
|
随访3: 配镜和用护理产品后1个月 |
同上随访2 |
同上随访2 |
同上随访2 |
同上随访1 |
同上随访2 |
同上随访2 |
|
|
随访4: 配镜和用护理产品后3个月 |
同上随访1 |
同上随访1 |
同上随访2 |
同上随访1 |
同上随访2 |
同上随访1 |
|
注:随访包括试验前筛选、入选、镜片配戴及护理产品使用要求。在入选前应完成试验前筛选和签署知情同意书,并对自觉症状及体征进行基础评估,然后根据整体检查结果发放试验用护理产品和镜片。