本指导原则旨在指导和规范一次性医用喉罩产品的技术审评工作,帮助审评人员理解和掌握该类产品原理/机理、结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性作出系统评价。
本指导原则所确定的核心内容是在目前的科技认识水平和现有产品技术基础上形成的,因此,审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。
本指导原则不作为法规强制执行,不包括行政审批要求。但是,审评人员需密切关注相关法规的变化,以确认申报产品是否符合法规要求。
一、适用范围
本指导原则的适用范围为按第Ⅱ类医疗器械管理的一次性医用喉罩产品,分类代号为6866。
二、技术审评要点
(一)产品名称的要求
一次性医用喉罩产品以产品结构和应用范围为依据命名。产品名称中可带有表示材质的描述性词语,如“PVC”、“硅胶”等字样。
(二)产品的结构和组成
典型的一次性医用喉罩产品按外形结构主要有普通型(见图1)、加强型(见图2)。产品所用材料主要有硅胶、PVC(聚氯乙烯)、PE(聚乙烯)等。
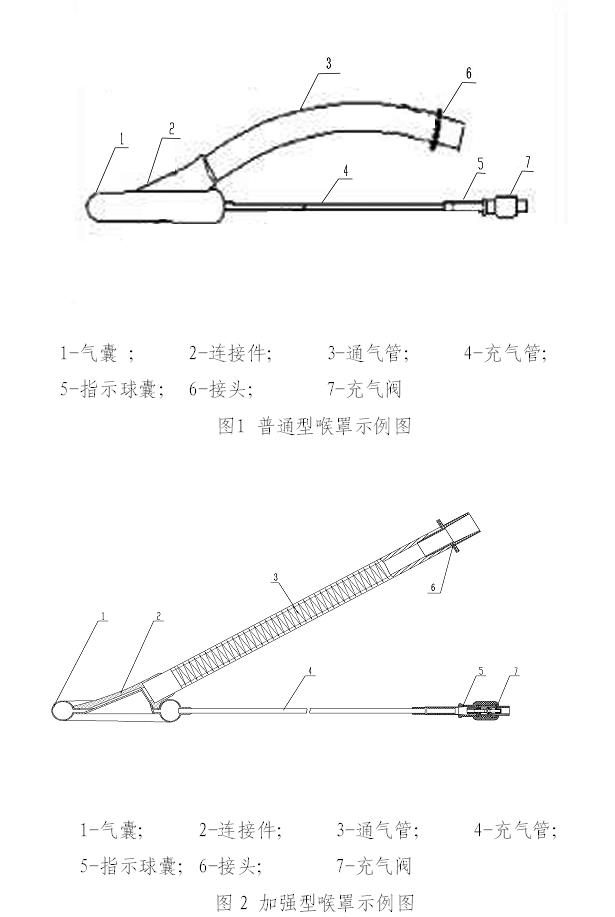
一次性医用喉罩产品主要用于打开并密封上喉部,在进行自主、辅助或控制通气时,在患者体内提供一个气体通道。使用时,将喉罩插入咽喉部,气囊充气后起到密封和固定作用。一次性医用喉罩既可为患者自主呼吸提供通道,又能施行正压通气。充气阀为单向阀,防止气囊内气体外泄,医生可通过指示球囊瘪下或鼓起的状态来监视气囊是否处在正常工作状态。插、拔喉罩前,先对气囊放气,然后进行插或拔。
(四)产品适用的相关标准
表1 相关产品标准
|
GB/T 191-2008 |
《包装储运图示标志》 |
|
GB/T 1962.1-2001 |
《注射器、注射针及其他医疗器械用6%(鲁尔)圆锥接头 第1部分:通用要求》 |
|
GB/T 2828.1-2012 |
《计数抽样检验程序 第1部分:按接受质量限(AQL)检索的逐批检验抽样计划》 |
|
GB/T 2829-2002 |
《周期检验计数抽样程序及表(适用于对过程稳定性的检验)》 |
|
GB/T 14233.1-2008 |
《医用输液、输血、注射器具检验方法 第1部分:化学分析方法》 |
|
GB/T 14233.2-2005 |
《医用输液、输血、注射器具检验方法 第2部分:生物学试验方法》 |
|
GB/T 16886.1-2011 |
《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》 |
|
GB/T 16886.3-2008 |
《医疗器械生物学评价 第3部分:遗传毒性、致癌性和生殖毒性试验》 |
|
GB/T 16886.5-2003 |
《医疗器械生物学评价 第5部分:体外细胞毒性试验》 |
|
GB/T 16886.6-1997 |
《医疗器械生物学评价 第6部分:植入后局部反应试验》 |
|
GB/T 16886.10-2005 |
《医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验》 |
|
GB/T 16886.11-2011 |
《医疗器械生物学评价 第11部分:全身毒性试验》 |
|
YY/T 0313-1998 |
《医用高分子制品包装、标志、运输和贮存》 |
|
YY 0337.1-2002 |
《气管插管 第1部分:常用型插管及接头 》 |
|
YY/T 0466.1-2009 |
《医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求》 |
|
YY 1040.1-2003 |
《麻醉和呼吸设备 圆锥接头 第1部分:锥头与锥套》 |
|
ISO 14155-1 |
《用于人体的医疗器械的临床研究 第1部分:一般要求》 |
|
ISO 14155-2 |
《用于人体的医疗器械的临床研究 第2部分:临床研究计划》 |
上述标准包括了注册产品标准中经常涉及到的标准。有的企业还会根据产品的特点引用一些行业外的标准和一些较为特殊的标准。
产品适用及引用标准的审查可以分两步来进行。首先对引用标准的齐全性和适宜性进行审查,也就是在编写注册产品标准时是否引用了与产品相关的国家标准、行业标准,以及引用是否准确。可以通过对注册产品标准中“规范性引用文件”是否引用了相关标准,以及所引用的标准是否适宜来进行审查。此时,应注意标准编号、标准名称是否完整规范,年代号是否有效。其次对引用标准的采纳情况进行审查。即,所引用的标准中的条款要求,是否在注册产品标准中进行了实质性的条款引用。这种引用通常采用两种方式,文字表述繁多内容复杂的可以直接引用标准及条文号,比较简单的也可以直接引述具体要求。
注意“规范性引用文件”和“标准编制说明”中编写标准所引用或参照相关标准和资料的区别,通常不宜直接引用或全面引用的标准不纳入规范性引用文件,而仅仅以参考文件在编制说明中出现。
如有新版强制性国家标准、行业标准发布实施,产品性能指标等要求应执行最新版本的国家标准、行业标准。
(五)产品的预期用途
一次性医用喉罩主要用于打开并密封上喉部,在进行自主、辅助或控制通气时,在患者体内提供一个气体通道。
(六)产品的主要风险
1. 风险分析方法
(1)在对风险的判定及分析中,要考虑合理的可预见的情况,它们包括:正常使用条件下和非正常使用条件下。
(2)风险判定及分析应包括:对于患者的危害、对于操作者的危害和对于环境的危害。
(3)产品每项危害产生的伤害和侵害的定量或定性的风险评估。
(4)风险形成的初始原因应包括:人为因素(包括不合理的操作)、产品结构的危害、原材料危害、综合危害和环境条件。
(5)风险判定及分析考虑的问题包括:产品原材料生物学危害;产品质量是否会导致使用中出现不正常结果;操作信息(包括警示性语言、注意事项以及使用方法)的准确性;留置使用可能存在的危害等。
2. 风险分析清单
一次性医用喉罩产品的风险管理报告应符合《医疗器械 风险管理对医疗器械的应用》(YY/T 0316-2008)的有关要求,审查要点包括:
(1)产品定性定量分析是否准确(依据YY/T 0316-2008 附录C)。
(2)危害分析是否全面(依据YY/T 0316-2008附录E)。
(3)风险可接收准则。
(4)产品风险评估。降低风险的措施及采取措施后风险的可接受程度,是否有新的风险产生。
根据YY/T 0316-2008附录E对“一次性医用喉罩”已知或可预见的风险进行判定,产品在进行风险分析时至少应包括以下的主要危害,企业还应根据自身产品特点确定其他危害。针对产品的各项风险,企业应采取应对措施,确保风险降到可接受的程度。
表2 产品主要危害
|
危害 |
可预见的事件序列 |
危害处境 |
损害 |
|
生物学危害(微生物污染) |
(1)生产环境控制不达标 (2)灭菌操作不严格 |
产品带菌 |
引起患者感染 |
|
化学的 (不正确的配比) |
(1)未按照工艺要求配料 (2)添加剂或助剂使用比例不正确 |
(1)可能引起小分子物质残留量过大,造成毒性危害 (2)产品易老化 |
器官损伤 功能性丧失 |
|
生物相容性 |
(1)原材料配方不正确 (2)加工工艺控制不严格 (3)后处理工艺控制不严格 |
残留物过多,如:PVC:氯乙烷超标、增塑剂量过大 硅胶:硫化剂分解不完全,紫外吸光超标,可能产生刺激 |
器官损伤 毒性或刺激 致癌 |
|
运输和储存 (不适当的环境条件) |
储存条件或运输条件偏离预定的环境条件(如温度、湿度) |
(1)产品非正常老化 (2)无菌有效期缩短,产品带菌 |
功能性、使用性丧失 引起患者感染 |
|
储运、使用过程中发生意外的机械性破坏 |
(1)产品带菌 (2)产品使用性能无法得到保证 |
引起患者感染 功能性、使用性丧失 |
|
|
废弃物处理 |
废弃物或医疗器械处置的污染,如:使用后的产品没有按照要求集中销毁 |
造成环境污染或细菌病毒扩散 |
环境污染 交叉感染 |
|
标记 |
(1)标记不清晰、错误 (2)没有按照要求进行标记 |
(1)错误使用 (2)储存错误 (3)产品辨别错误 (4)导致无法保证使用安全性 |
引起患者感染 器官损伤 操作失效 |
|
操作说明书 |
(1)与其他医疗器械一起使用的说明不适当 (2)预先检查规范不适当 (3)操作说明不准确 |
错误使用,导致无法保证使用安全性 |
器官损伤 操作失效 |
|
人为因素(由不熟练/未经培训的人员使用) |
(1)插、拔操作不规范 (2)放置位置不对 (3)头部位置不对 (4)打折或移位 (5)密封表面打折或扭曲 (6)体位变化 (7)规格型号选用错误 |
(1)造成咽部粘膜摩擦性损伤 (2)呼吸道部分或者完全性梗阻 (3)当医用喉罩不能准确占据下咽部,正压通气中气体可进入胃中 (4)通气不畅 (5)密封不足 (6)密封失效或降低 (7)密封过盈 |
(1)咽喉疼痛、呼吸道阻塞、喉神经损伤与声带麻痹 (2)发生胃胀气 (3)误吸或反流,造成误吸性肺炎 (4)导致无法达到满意的通气效果,操作失效 |
|
警告 |
对副作用的警告不充分 |
对操作人员警示提示不足 |
器官损伤 操作失效 |
|
对一次性使用医疗器械很可能再次使用的危害警告不适当 |
重复使用 |
交叉感染 |
|
|
功能性失效、老化引起的危害 |
对医疗器械寿命终止缺少适当的规定,没有产品标识或标示不清 |
超出有效期的产品被使用,产品带菌或老化 |
引起患者感染或者交叉感染 功能性、使用性丧失 |
|
充气管及单向阀故障 |
(1)密封不足 (2)密封失效或降低 (3)密封过盈 |
导致无法达到满意的通气效果,操作失效 误吸或反流 |
|
|
内腔容积增加 |
密封不足 |
||
|
通气管破裂 |
通气不畅 |
||
|
不适当的包装 |
没有进行包装确认或确认不准确 |
造成产品污染,从而导致出现细菌感染 |
(七)产品的主要技术指标
本条款给出一次性医用喉罩需要考虑的产品基本技术性能指标,企业应参考相应的国家标准、行业标准,根据企业自身产品的技术特点制定相应的注册产品标准。以下技术指标如有不适用生产企业产品的条款(包括国家标准、行业标准要求),应该在注册标准编制说明中说明理由。
1. 物理性能:
(1) 产品型号、规格、尺寸、外观
应由生产企业根据实际产品在注册产品标准中具体编写。
喉罩的规格设计一般遵循以下协定:
1)规格范围应从0到6,允许的最小增量是0.5;
2)规格0到6应设计对应产品规格从最小到最大,从儿童到成人过渡的规格是3。
对加强型喉罩外观应包括支撑钢丝不得外露。
(2)通气开口
在喉罩的病人端或病人端附近要有一个允许通气的孔,可以做一个辅助通气开口以降低堵塞的风险。
(3)连接牢固度
接头与通气管、充气管与气囊、通气管与连接件连接应牢固,在承受15N轴向静拉力作用下持续15s,不得脱落或分离、断裂。
(4)接头
1)机器端应为一个15mm的外圆锥接头,尺寸应符合YY 1040.1—2003中的规定。内径的任何变化都应该是渐进的,方便器械穿过和移动。
2)病人端开口应有一个与接头病人端的长轴成90°±5°的平面。
(5)充气系统
1)充气系统应包括一根充气管、一个指示球囊或其他能够指示充气或放气的装置。
2)充气管的自由端应是开口的,用一个密封装置或充气阀封闭。如果需要与外部充气装置有接触面,充气管自由端应能够与装有符合GB/T 1962.1-2001的6%(鲁尔)外圆锥接头相匹配。
3)气囊放气时,充气管、充气阀或其他起单向阀作用的密封装置不应阻碍放气。
(6)密封性
1)在10cmH2O的正压下,最少3s内气囊密封不应产生可听的泄漏。
注:应通过临床研究测试来检验是否符合要求。功能测试器或患者模拟器不应用来验证喉罩的性能。临床研究应记录在保证声明的产品性能的条件下的测试结果。临床研究应符合ISO 14155-1和ISO 14155-2的要求。因此,该项要求可不写入注册产品标准,但应提供临床研究测试资料。
2)喉罩气囊、通气管、充气系统及各连接处应密封良好,应无漏气现象。
(7)气囊不能堵塞通气开口或导致呼吸通路塌陷。
注:应通过对生产企业选择的、基于对风险评估和相应的验证、确认研究中风险降低措施的方法的检查来评价是否符合要求。因此,该项要求可不写入注册产品标准,但应提供评价研究资料。
(8)生产企业应制定通气管内腔抗弯曲能力要求。
(9)生产企业应制定内腔容积的要求。
(10)生产企业应规定能够容易穿过呼吸通路的器械的最大规格(如适用)。
(11)通气管管体标识
1. 生产企业的名称或商标;
2)用粗体标记规格,包含一系列规格的喉罩应标明相应的范围;
3)“一次性使用”字样或等效标识;
4)标称插入深度标记或指示,它围绕在上喉部通气道的管身上,对应于患者的门齿或牙龈,用来指示预期插入深度的典型范围;
注:插入深度范围标记不需要在管身整个圆周上连续标记出来。
5)从通气开口病人端开始,以cm为单位标出深度标识(如提供)。
(12)标记的材料应:
1)能抵抗因麻醉剂引起的老化;
2)在使用过程中保持字迹清晰。
2. 化学性能:
根据不同材料特性,由企业决定是否对化学性能提出要求,至少应包括pH值。用环氧乙烷灭菌的产品应规定环氧乙烷残留量的要求,应不大于10μg/g。
3. 生物性能:
一次性医用喉罩应以无菌形式提供,并进行细胞毒性、口腔粘膜刺激、迟发型超敏反应的生物学评价。
(八)产品的检测要求
产品的检测包括出厂检验和型式检验。
出厂检验至少包括型号、规格、尺寸、外观、环氧乙烷残留量(若采用环氧乙烷灭菌)、无菌的检验。
型式检验报告是证实生产过程有效性的文件之一。产品注册申请时提供的型式检验报告,应由有资质的检验机构进行。型式检验时,若标准中无特殊规定,按相应的标准要求进行全性能检验,应全部合格。
(九)产品的临床要求
临床试验机构应为国家食品药品监督管理部门会同国家卫生计生部门认定公布的临床试验基地。临床试验应按照《医疗器械临床试验规定》(国家食品药品监督管理局令第5号)及《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)附件12的要求进行,同时应注意以下要求:
1. 确保受试人群具有代表性,充分考虑成人、小儿的差别。
2. 明确产品型号、规格、用途。
3. 临床试验例数为受试者人数,而不是使用产品的数量。
4. 试验持续时间应根据受试者的状况和产品预期用途以及统计学的要求确定,例如:受试者的需要应用一次性医用喉罩的时间、产品允许留置人体的时间等。
5. 临床对照一般采取随机对照的方式,即受试者随机分配至试验组和对照组进行临床试验,最后将结果进行比较。应明确对照产品注册证号、生产厂家等信息。
6. 应明确进行临床研究的科室、临床负责人、参与者等信息。
7. 若提交同类产品临床试验资料或临床文献资料的医疗器械,则应满足:
(1)如果提交其他企业已上市的同类产品临床试验报告或临床文献资料,则应提供详细的对比说明,包括产品基本原理、结构组成、材料、主要技术性能指标、适用范围、禁忌症等方面的比对;
(2)如果两种产品的材料不一致,如硅胶、PVC等,则应提供材料安全性等同的证明文件;
(3)临床文献资料是指“两篇省级以上核心医学刊物公开发表的能够充分说明产品预期临床使用效果的学术论文、专著以及文献综述”。
8. 对临床试验中如何正确使用产品,生产企业应提供必要的培训。
(十)产品的不良事件历史记录
暂未见相关报道。
(十一)产品说明书、标签和包装标识
产品说明书、标签和包装标识的编写要求应符合《医疗器械说明书、标签和包装标识管理规定》(国家食品药品监督管理局令第10号)、《医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求》(YY 0466.1-2009)和《医用高分子制品包装、标志、运输和贮存》(YY/T 0313-1998)等相关标准的要求。同时应注意以下要求:
1. 根据注册资料及有关技术文件,明确产品的适用人群(如按体重或按成人、小儿等)。
2. 使用说明书,包括喉罩正确的插入和固定方法。
3. 对产品允许留置人体的时间进行说明。
4. 对使用长时间留置产品的患者如何监护进行说明。
5. 与其他器械一起使用时的使用说明,若标示。
6. 按规定的测试方法,可适用的其他器械的最大规格。
7. 内腔容量,以mL表示。
8. 按规定流量测试时的压降,以cmH2O表示。
9. 插入时最小齿间间隔,以mm表示。
10. 喉罩的示意图,显示其主要部件,包括从接头的机器端到通气开口的内部通路的公称长度,以cm为单位表示,以及显示喉罩内部其他任何工作通道。
11. 显示上喉部通气道解剖部位预期位置的一个示意图;在风险评估和相关的验证和确认研究中作为降低风险措施的解剖部位也应标记出来。
12. 应提示对产品材料过敏者禁用。
13. 喉罩含有天然橡胶(乳胶)的警告(如适用)。
14. 应提示饱食、未禁食,具有反流危险者慎用。
15. 应提示气管受压和软化的病人麻醉后发生呼吸道梗阻者禁用。
16. 应提示咽喉部病变导致呼吸道梗阻、肺顺应性降低或呼吸道阻力高需要正压通气者慎用。
17. 应提示喉部水肿、呼吸道急性炎症及咽喉部脓肿患者慎用。
18. 如果喉罩不能使气管或者肺避免误吸风险,则应给出警告。
19. 当患者的头部或者颈部位置发生变化时宜再次确认喉罩畅通的警示。
20. 在N2O、O2或其他医用气体存在的情况下气囊容积或压力会改变的警告(如适用)。
21. 在激光和电灼设备存在的情况下喉罩可能易燃的警告。
22. 应标明一次性使用,用后销毁,包装如有破损,严禁使用。
23. 应标明灭菌方式、灭菌日期、无菌有效期。
24. 证明符合标准要求的一系列方法、材料、数据和临床研究结果可供获取的声明(如适用)。
25. 关于生物性危害物处理的预防措施相关信息。
26.生产企业应说明其合适的存储条件。
(十二)注册单元划分的原则和实例
《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)第二十七条规定:医疗器械产品的注册单元原则上以技术结构、性能指标和预期用途为划分依据。
例如:普通型、加强型基本性能指标和预期用途都基本一样,可以作为一个注册单元。
(十三)同一注册单元中典型产品的确定原则和实例
1. 同一注册单元中的典型产品是指能够代表本注册单元内其他产品安全性和有效性的产品。其功能最齐全、结构最复杂、风险最高。
2. 典型产品的确定可以通过比较同一注册单元内所有产品的技术结构、性能指标和预期用途等相应资料,说明其能够代表本注册单元内其他产品的安全性和有效性。
例:普通型和加强型一次性医用喉罩,如果通过申报资料知道两种型号产品预期用途一致,生物、化学指标一致,而加强型的物理等性能指标涵盖普通型的指标,能够代表两种产品的安全性、有效性。则由此可以确定加强型一次性医用喉罩为这两种产品的典型产品。
一次性医用喉罩产品注册技术审查指导原则
编制说明
一、指导原则编写的原则
(一)本指导原则编写的目的是用于指导和规范第二类一次性医用喉罩产品注册申报过程中审查人员对注册材料的技术审评。
(二)本指导原则旨在让初次接触该类产品的注册审查人员对产品机理、结构、主要性能、预期用途等各个方面有个基本了解,同时让技术审查人员在产品注册技术审评时把握基本的尺度,对产品安全性、有效性作出系统评价。
二、指导原则编写的依据
(一)《医疗器械监督管理条例》
(二)《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)
(三)《医疗器械临床试验规定》(国家食品药品监督管理局令第5号)
(四)《医疗器械说明书、标签和包装标识管理规定》(国家食品药品监督管理局令第10号)
(五)《医疗器械标准管理办法》(国家药品监督管理局令第31号)
(六)关于印发《境内第一类医疗器械注册审批操作规范(试行)》和《境内第二类医疗器械注册审批操作规范(试行)》的通知(国食药监械〔2005〕73号)
(七)国家食品药品监督管理部门发布的其他规范性文件
(八)相关现行的国家标准和行业标准
三、指导原则中部分具体内容的编写考虑
(一)随着医疗技术的发展与进步,根据临床使用要求可能会产生一些附加功能的衍生产品,如:插管型、食道引流型、插管及食道引流的多功能型、免充气型等。衍生产品的附加功能要求应符合相应标准的要求。
(二)一次性医用喉罩产品为无菌形式提供。
(三)一次性医用喉罩产品的主要技术指标、风险分析是在编写人员对现有产品技术和风险的认知基础上制定的,供参考使用。
(四)产品的不良事件历史记录主要从河南省药品不良反应监测中心数据库中查找。
四、指导原则编写人员
本指导原则的编写成员由河南省食品药品监督管理局医疗器械产品注册技术审评人员、行政审批人员、器械检验人员、专业厂家代表、临床专家共同组成,以充分利用各方面的信息和资源,综合考虑指导原则中各个方面的内容,尽量保证指导原则正确、全面、实用。